
【题目】尿素![]() 是一种重要的化工产品,工业生产尿素的主要流程如下:
是一种重要的化工产品,工业生产尿素的主要流程如下:
![]()
(1)工业合成氨的化学方程式是_______。
(2)尿素分子中C、N原子间的共用电子对偏向N原子,从原子结构的角度解释原因:______。
(3)由NH3和CO2合成尿素分为两步反应(均为可逆反应),其能量变化示意图如下:
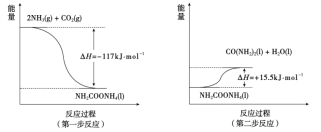
①合成尿素总反应的热化学方程式是_______。
②粗尿素中含有NH2COONH4杂质。通过控制温度和压强,可将NH2COONH4分解为NH3和CO2。研究温度和压强对NH2COONH4分解率的影响,结果如下:
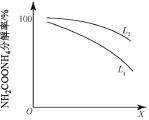
X代表_____(填“温度”或“压强”),L1_____L2(填“>”或“<”)。
(4)工业上含尿素的废水需经处理后才能排放。一种利用电化学方法降解尿素的装置示意图如下:
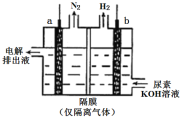
写出尿素被降解的电极反应式是______。
【答案】N2+3H2![]() 2NH3 N和C电子层数相同,核电荷数N>C,原子半径N<C,原子核吸引电子能力N>C CO2(g) + 2NH3(g) CO(NH2)2(l) + H2O(l) ΔH = –101.5 kJ·mol-1 压强 < CO(NH2)2+8OH––6e–=
2NH3 N和C电子层数相同,核电荷数N>C,原子半径N<C,原子核吸引电子能力N>C CO2(g) + 2NH3(g) CO(NH2)2(l) + H2O(l) ΔH = –101.5 kJ·mol-1 压强 < CO(NH2)2+8OH––6e–=![]() +N2↑+6H2O
+N2↑+6H2O
【解析】
根据C、N原子的得失电子能力分析共用电子对发生偏移的原因;根据图示的反应物与生成物的能量关系和盖斯定律正确书写热化学方程式;根据图示的电解池装置分子阳极失电子的物质和阴极得电子的物质,正确书写电极反应式。
(1)工业合成氨的化学方程式为:N2+3H2![]() 2NH3;
2NH3;
(2)C、N原子位于同一周期,且N原子的原子序数较大,N原子的原子半径较小,原子核对核外电子的吸引能力较强,C原子和N原子间的共用电子对也会向着N原子一方偏移;
(3)①根据图示的反应流程,氨和二氧化碳反应生成尿素的反应分两步,第一步反应的热化学方程式为2NH3(g)+CO2(g)NH2COONH4(l) ΔH=-117 kJ·mol-1,第二步反应的热化学方程式为NH2COONH4(l)CO(NH2)2(l)+H2O(l) ΔH=+15.5 kJ·mol-1,根据盖斯定律,将第一步反应和第二步反应相加即得到合成尿素的热化学方程式,热化学方程式为CO2(g)+2NH3(g)CO(NH2)2(l)+H2O(l) ΔH=-101.5 kJ·mol-1
②根据图像分析,NH2COONH4分解为NH3和CO2的反应为吸热反应,若X代表温度,升高温度平衡向吸热反应方向进行,NH2COONH4的分解率会逐渐增大,与图示不符;若X代表压强,增大压强平衡向气体系数和小的方向移动(即逆反应方向),NH2COONH4的分解率会逐渐降低,与图示相符,故X代表压强;图示中L代表温度,在相同温度下,升高温度平衡向吸热反应方向进行,NH2COONH4的分解率会逐渐增大,故L2>L1;
(4)根据图示的电解池装置,左侧a电极生成N2,说明尿素在此电极上失电子,为阳极,右侧b电极生成H2,说明水中的H+在此电极上得电子,为阴极,阳极的电极方程式为CO(NH2)2+8OH--6e-=![]() +N2↑+6H2O,阴极的电极方程式为2H2O+2e-=2OH-+H2↑,电解池的总反应为CO(NH2)2+2OH–=
+N2↑+6H2O,阴极的电极方程式为2H2O+2e-=2OH-+H2↑,电解池的总反应为CO(NH2)2+2OH–=![]() +N2↑+3H2↑。
+N2↑+3H2↑。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
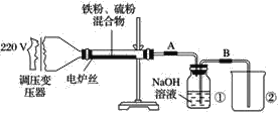
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有1L0.1mol/LCuSO4溶液的大烧杯中,用锌、铜作电极,用导线连接形成原电池,当电极锌消耗3.25g时,试完成:
(1)写出电极反应式:负极__________________;正极____________。
(2)电极上析出铜的质量。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,反应4Fe(OH)2(s)+ 2 H2O(l)+ O2(g)═ 4 Fe(OH)3(s)能自发进行,则△ H<0
B. 有气体参与的可逆反应,在一定条件下达到平衡时,改变压强平衡一定发生移动
C. 化学平衡常数只与温度有关,与化学计量数无关
D. t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)NO(g)+SO3(g),通入少量O2,![]() 的值及SO2转化率不变
的值及SO2转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
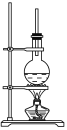
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用硫代硫酸钠进行了相关的实验。
Ⅰ.已知:Na2S2O3+H2 SO4 Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2=____,V3=___;
(2)若V4=10.0,V5=6.0,则实验①、③可探究_____对反应速率的影响。
Ⅱ.利用反应:I2+2Na2S2O3 Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用amol/L的碘水滴定,消耗碘水b mL,则:
(3)滴定时,将碘水注入___(填“酸式”或“碱式”)滴定管中,滴定应选择的指示剂是____,滴定终点的现象为________。
(4)对于该滴定实验的有关操作或误差分析正确的是____。
a.滴定前,要用对应装入的溶液润洗锥形瓶和滴定管
b.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
c.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
d.滴定前仰视读数而滴定结束时平视读数,则所测得的纯度将会偏小
(5)样品中硫代硫酸钠纯度的表达式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 。室温下用
。室温下用![]() 的
的![]() 滴定
滴定![]() 某一元酸
某一元酸![]() 的结果如图所示,下列说法中正确的是
的结果如图所示,下列说法中正确的是

A. ![]() 属于弱酸
属于弱酸
B. 整个过程中,![]() 点时水的电离程度最大
点时水的电离程度最大
C. ![]() 点对应液中
点对应液中![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0. 100 0 mol·L-1 NaOH溶液滴定20. 00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是( )

A.点①所示溶液中:c(CH3COO-)+2c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.滴定过程中可能出现:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com