
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| C. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 | |
| D. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
分析 A.有新物质生成的变化属于化学变化,没有新物质生成的变化为化学变化;
B.碘为微量元素,需要从食物中补充;
C.三价铁离子具有强的氧化性,能够氧化铜;
D.碳纤维是由有机纤维经碳化及石墨化处理而得到的微晶石墨材料.碳纤维的微观结构类似人造石墨,是乱层石墨结构和氮化硅属于无机物.
解答 解:A.用活性炭除去冰箱中的异味,没有新物质生成,是发生了物理变化,故A错误;
B.碘为微量元素,需要从食物中补充,可多吃海带等食物,或利用碘盐(含碘酸钾)补充,而不能吃富含高碘酸的食物,故B错误;
C.三价铁离子具有强的氧化性,能够氧化铜,而腐蚀铜,故C错误;
D.碳纤维的微观结构类似人造石墨,是乱层石墨结构和氮化硅属于无机物,属于无机非金属材料,故D正确;
故选:D.
点评 本题考查了生活中的化学,明确物理变化与化学变化的区别,熟悉盐类水解的应用是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1=-57.3kJ/mol是强酸和强碱在稀溶液中反应生成可溶性盐的中和热 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol | B. | 0.045mol | C. | 0.06mol | D. | 0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
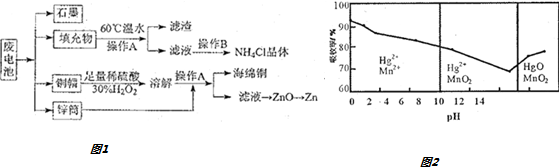
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,立即用水扑灭 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中 | |
| C. | 在量筒中配置100mL,1mol/L NaCl溶液 | |
| D. | 大量氯气泄漏时,尽量沿高处迅速离开现场 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生红褐色沉淀 | |
| D. | 滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com