
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ①③⑤⑦ | D. | ①③⑥⑧ |
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:填空题
 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置. ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.
,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:
在如图所示的量热计中,将100mL0.50mol•L CH3COOH溶液 与100mL0.55mol•L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,溶液的密度均近似为1g•mL-1.实验中某同学计算中和热,记录数据如下:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 醋酸溶液 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 25.0 | 25.1 | 27.8 |
| 2 | 25.1 | 25.3 | 27.9 |
| 3 | 25.2 | 25.5 | 28.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
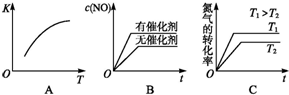 汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0已知该反应在2404℃时,平衡常数K=64×10-4.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H-OH$\stackrel{催化剂}{→}$ CH3CH2OH | |
| B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$ 2HCl | |
| C. | CH3CH2Br+KOH$→_{△}^{H_{2}O}$CH3CH2OH+KBr | |
| D. | CH3CH3+2Cl2 $\stackrel{光}{→}$ +2HCl +2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com