
【题目】对植物的光合作用起关键作用的化学元素是
A. K B. Mg C. Na D. Si
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B. SO2、乙烯都能使溴水褪色,但原理不同
C. NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D. FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。
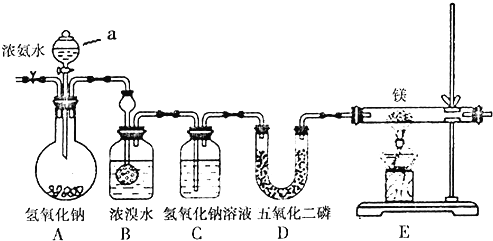
已知:氮化镁易跟水发生反应;装置B中发生的主要反应为:3Br2+2NH3=6HBr+N2、HBr+NH3=NH4Br。
实验步骤及现象:
①连接仪器并检查装置的气密性。
②通入惰性气体。
③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④点燃酒精灯,观察E中固体变成了黄绿色。
回答下列问题:
(1)A装置中仪器a的名称为______,通入惰性气体的目的是__________________。
(2)装置C的作用是______________________。
(3)D装置中的P2O5是一种非氧化性的酸性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______。
a.NH3 b. HI c. SO2 d. CO2
(4)E装置中发生反应的化学方程式为:___________________________。
(5)此装置中存在着明显缺陷,你的改进措施是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是________或________。
(2)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为_____________________。
(3) 工业制漂白粉的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含1 mol复盐NH4Al(SO4)2稀溶液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3·H2O的物质的量为( )
A. 0 mol B. 0.2mol C. l mol D. 0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法中错误的是( )
物质 | 杂质 | 除杂质的方法 | |
A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A. 3:1 B. 2:1 C. 1:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质铝应用极为广泛,从铝土矿中提取铝主要分以下三个阶段,根据要求回答相关问题
(1)铝土矿的提纯:铝土矿主要成分是Al2O3(含有Fe2O3、SiO2等杂质),提纯流程如下图所示:
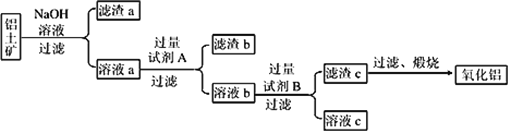
①在用NaOH溶液母液浸提过程中需研碎、湿磨,其目的是______________________________。
②向溶液a中通入过量CO2,所得不溶物煅烧后也可得Al2O3,该方法的缺点是___________________________________________________。
(2)制备无水氯化铝
其反应为:2Al2O3+6Cl2![]() 4AlCl3+O2
4AlCl3+O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是_____________________________。
(3)电解制取铝
目前可低温电解AlCl3熔盐得到金属铝纯的无水氯化铝熔点190℃,沸点180℃,其导电性如图:
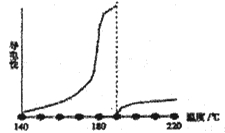
①从图中可知,AlCl3熔融液导电能力___________________________。
②但若在AlCl3中加入NaCl,使形成共融物,将AlCl3制成离子型液体,导电能力增强,熔融液中存在的阴离子是Cl-、AlCl4-、Al2Cl7-,请写AlCl3加入NaCl后形成离子型液体的两个离子方程式:AlCl3+ Cl-=AlCl4-、及平衡________________________________。
③电解时,阳极主要是AlCl4-放电,其电极反应为__________________________________。
④为保证电解进行,熔融液主要离子是AlCl4-、Al2Cl7-,则n(AlCl3)∶n(NaCl)应大于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com