
【题目】某药物中间体X的合成路线如下:
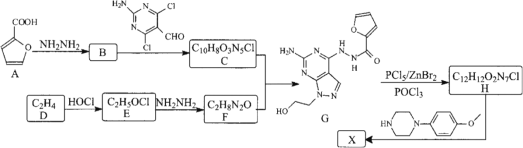
已知:①RX+![]()
![]()
![]() +HX; ②-NH2+RCHO
+HX; ②-NH2+RCHO![]() RCH=N-;
RCH=N-;
③R-OH![]() ; ④
; ④![]()
![]()
![]() 。
。
请回答:
(1) F的结构简式为________。
(2) 下列说法正确的是________。
A H→X的反应类型属于加成反应
B 化合物F具有弱碱性
C 化合物G能发生取代、消去、还原反应
D 化合物X的分子式为C23H27O3N9
(3) 写出B→C的化学方程式________。
(4) ![]() 可以转化为
可以转化为![]() 。设计以苯酚和乙烯为原料制备
。设计以苯酚和乙烯为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
(5) 写出化合物B同时符合下列条件的同分异构体的结构简式。
①分子中有一个六元环,无其它环状结构;________
②1HNMR谱表明分子中有2种氢原子;IR谱显示存在-CN________。
【答案】![]() 或HOCH2CH2NHNH2 BCD
或HOCH2CH2NHNH2 BCD  +
+
![]()

+HCl 
![]() 、
、 ![]()
![]() 、
、 ![]()
【解析】
从E到F的分子式的变化分析,物质E和NH2NH2的反应为取代反应,另外的产物为氯化氢,则推断B的结构简式为![]() ,根据信息①分析,C的结构简式为
,根据信息①分析,C的结构简式为 ,E的结构简式为HOCH2CH2Cl,F的结构简式为HOCH2CH2NHNH2。
,E的结构简式为HOCH2CH2Cl,F的结构简式为HOCH2CH2NHNH2。
(1)根据以上分析可知F的结构简式为 ![]() 或HOCH2CH2NHNH2 ;
或HOCH2CH2NHNH2 ;
(2) A.H的结构中含有氯原子,结合信息①分析,H→X的反应类型属于取代反应,故错误;
B.化合物F的结构简式为HOCH2CH2NHNH2,含有氨基,具有弱碱性,故正确;
C.化合物G含有的官能团为羟基,羰基,碳氮双键,碳碳双键,所以能发生取代、消去、还原反应,故正确;
D.结合信息①分析,H的分子式为C12H12O2N7Cl,与之反应的分子式为C11H16ON2,该反应为取代反应,生成的另外的产物为氯化氢,则化合物X的分子式为C23H27O3N9,故正确。选BCD;
(3)B到C为取代反应,方程式为: ![]() +
+
![]()
 +HCl;
+HCl;
(4) 以苯酚和乙烯为原料制备![]() 的合成路线,从逆推方法入手,需要合成的物质为
的合成路线,从逆推方法入手,需要合成的物质为![]() 和HN(CH2CH2Br)2,
和HN(CH2CH2Br)2,![]() 由苯酚和浓硝酸反应生成,乙烯和溴发生加成反应生成1,2-二溴乙烷,再与氨气反应生成HN(CH2CH2Br)2即可。合成路线为:
由苯酚和浓硝酸反应生成,乙烯和溴发生加成反应生成1,2-二溴乙烷,再与氨气反应生成HN(CH2CH2Br)2即可。合成路线为:  ;
;
(5)化合物B的分子式为C5H6O2N2,其同分异构体同时符合下列条件:
①分子中有一个六元环,无其它环状结构;②1HNMR谱表明分子中有2种氢原子;IR谱显示存在-CN,说明结构有对称性,除了-CN外另一个氮原子在对称轴上,两个氧原子在六元环上,且处于对称位,所以结构可能为 ![]() 、
、 ![]() 、
、![]() 、
、 ![]() 。
。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaHSO3溶液中的水解方程式:HSO3+H2O=H3O++![]()
B.FeI2溶液中加双氧水,出现红褐色沉淀:6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+
C.10 mL 0.1 mol·L1 NaOH溶液中滴加几滴AlCl3溶液:Al3++3OH=Al(OH)3↓
D.3a mol CO2通入含2a mol Ba(OH)2的溶液中:3CO2+4OH+Ba2+=BaCO3↓+2![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子式 C8H10 的苯的同系物共有 3 种结构
B.![]() 与
与![]() 互为同系物
互为同系物
C.三联苯(![]() )的一氯代物有 4 种
)的一氯代物有 4 种
D.立方烷(![]() )经硝化可得到六硝基立方烷,其可能的结构有 3 种
)经硝化可得到六硝基立方烷,其可能的结构有 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关微粒结构的表示或说法不正确的是( )
A.氮分子的电子式为::N:::N:
B.氨分子的空间构型为三角锥型,属于极性分子
C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子
D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
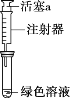
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO

①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法不正确的是

A.钢铁腐蚀时化学能不能全部转化为电能
B.钢铁腐蚀的负极反应式为Fe-2e-=Fe2+
C.如图所示,将导线与金属锌相连可保护地下铁管
D.如图所示,将导线与外接电源的正极相连可保护地下铁管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列结构示意图,判断下列说法中正确的是( )
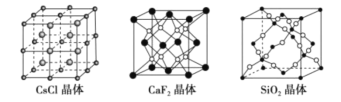
A.在CsCl晶体中,距Cs+最近的Cl-有6个
B.在CaF2晶体中,Ca2+周围距离最近的F-有4个
C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子
D.在SiO2晶体中,最小环上有12个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔的前景。从海水中提取 Br2与 MgCl2 6 H2O 的流程如下:

(1)为节约成本 ,试剂①最好选用____________。[填“NaOH”或“Ca( OH )2”]
(2)提取溴过程中,从溶液 l 到溶液 4 , 两次进行 Br -→Br2的转化,目的是____。
(3)提取溴过程中,形成溶液 3 的化学方程式是___________________ 。
(4)用原子结构原理解释Cl2的氧化性强于 Br2的原因 ___________________。
(5)提镁过程中,加入试剂②发生反应的离子方程式是 _________________。
(6)从 MgCl2溶液获得MgCl26 H2O晶体的主要操作为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com