
分析 强电解质是指在水溶液中或熔融状态下能完全电离的化合物,包括强酸、强碱、绝大多数盐和金属氧化物,据此分析.
解答 解:①氢氧化钡是强碱,是强电解质,故①正确;
②H2SO4 是强酸,是强电解质,故②正确;
③醋酸是弱酸,是弱电解质,故③错误;
④氢气是单质,既不是电解质也不是非电解质,更不是强电解质,故④错误;
⑤澄清石灰水是混合物,既不是电解质也不是非电解质,更不是强电解质,故⑤错误;
⑥硫酸钡是盐,是强电解质,故⑥正确;
⑦二氧化碳是非电解质,故不是强电解质也不是弱电解质,故⑦错误;
⑧乙醇是非电解质,故不是强电解质也不是弱电解质,故⑧错误;
⑨水是弱电解质,故⑨错误.
故答案为:①②⑥.
点评 本题考查了强弱电解质的判断,应注意的是强电解质首先得是电解质,即必须是化合物,然后根据能否完全电离来分析.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下甲能与氢气直接化合,乙不能 | |
| B. | 甲的氧化物对应的水化物酸性比乙强 | |
| C. | 甲得到电子能力比乙强 | |
| D. | 甲、乙形成的化合物中,甲显负价,乙显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取28.6g Na2CO3•10H2O晶体 | |
| B. | 将Na2CO3固体放入容器瓶中,加水至刻度线 | |
| C. | 定容时俯视液面,所得溶液浓度偏低 | |
| D. | 加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
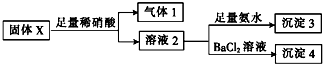
| A. | 气体1一定含NO可能含CO2 | |
| B. | 沉淀3一定含Mg(OH)2一定不含Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有MgCl2和Na2SO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全氧化56g Fe需要消耗氯气33.6 L | |
| B. | 7.8g Na2O2溶于100ml水,转移电子数为0.1NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com