
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
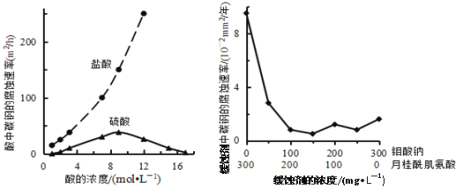
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
科目:高中化学 来源: 题型:
【题目】下列反应中,HCl只作氧化剂的是
A. CuO+2HCl=CuCl2+H2O
B. Zn+2HCl=ZnCl2+H2↑
C. 2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
D. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=lgKa,25℃时,H2SeO3 的 pKa1=1.34, pKa2=7.34。用 0.1molL1NaOH 溶 液滴定 20mL0.1molL1H2SeO3 溶液的滴定曲线如图所示(曲线上的数字为 pH)。下列说法不正 确的是

A. a 点所得溶液中:2c(H2SeO3)+c(SeO32)<0.1 molL1
B. b 点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32)+c(OH)
C. c 点所得溶液中:c(Na+)<3c(HSeO3)
D. d 点所得溶液中:c(Na+)>c(SeO3)>c(HSeO3 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 相同温度下,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
B. CH3COOH 溶液加水稀释后,溶液中 ![]() 的值减小
的值减小
C. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,冰醋酸(纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:

(1)用湿润的pH试纸测量a处溶液的pH,测量结果______(偏大、偏小或不变)
(2)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①醋酸的电离程度:_________。
②a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:______。
(3)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是______。
A.c(H+) B.H+个数 C.CH3COOH个数 D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
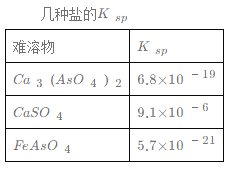
(1)若酸性废水中Fe3+的浓度为1.0×10-4 mol·L-1,则c(AsO43-)不超过 ____mol·L-1。
(2)工厂排放出的酸性废水中的三价砷(弱酸H3AsO3)不易沉降,可投入MnO2先将其氧化成五价砷 (弱酸H3AsO4),此时MnO2被还原为Mn2+,该反应的离子方程式为_________________。
(3)砷酸(H3AsO4)分步电离的平衡常数(25 ℃)为Ka1=5.6×10-3,Ka2=1.7×10-7,Ka3=4.0×10-12,第三步电离的平衡常数表达式为Ka3=_________,Na3AsO4第一步水解的离子方程式为AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25 ℃)为____。
HAsO42-+OH-,该步水解的平衡常数(25 ℃)为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、化学实验是化学学习的重要内容,根据你掌握的知识,完成下面内容。实验室需要配制0.1mol·L-1 NaOH溶液230mL,请回答下列问题:
(1)用天平称取______ g NaOH。配制过程中所需玻璃仪器除了胶头滴管和烧杯,还有_____、______ 。
(2)溶解NaOH后的溶液需冷却到室温后方能转移。若趁热转移会使溶液的浓度 _____(填“偏大”、或“偏小”,下同)
(3)有人认为,用这种方法只能配制0.1mol· L-1 的NaOH溶液,而无法得到0.1000mol· L-1 的NaOH溶液,你觉得他的理由是____________ 。
Ⅱ.氯气是一种重要的化工原料,自来水消毒、农药生产、药物合成都需要它。

(1)工业上通常采用电解法制氯气,请观察图1后回答下列问题:
通电后,b侧产生的气体用湿润的淀粉碘化钾试纸检验,现象是变蓝。化学方程式_____
(2)某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
①在A装置中制取氯气,请写出反应的化学方程式 ____________。
②漂白粉在U形管中产生,其化学方程式是 ____________。
③装置C的作用是__________。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应发生,可采取的措施是_______。
②试判断另一个副反应(用化学方程式表示)________,为避免此副反应的发生,可以在A与B之间连接一个装有_______ 的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X原子在第二电子层上只有一个空轨道,则X是__;其轨道表示式为__;R原子的3p轨道上只有一个未成对电子,则R原子可能是__、 ;Y原子的核电荷数为29,其电子排布式是__,其在元素周期表中的位置是__,是属于__区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:__、__、__。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子__。![]()
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)__。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4__H2SO3;H3PO4__H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为__杂化,分子的立体构型为__。
BF3分子中,中心原子的杂化方式为__杂化,分子的立体构型为__。
(7)H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com