
最近美国宇航局马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”——全氟丙烷(C3F8),并提出用其“温室化火星”使火星成为第二个地球的计划。下列有关全氟丙烷的说法正确的是( )
A.全氟丙烷的电子式为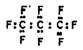
B.C3F8属于烃类物质
C.全氟丙烷分子中存在极性键
D.分子中三个碳原子可能处于同一直线上
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:2015-2016学年江苏省高一5月月考化学试卷(解析版) 题型:选择题
下列各组中两个化学反应,属于同一反应类型的一组是
A. 由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯
B. 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷
C. 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
D. 由苯制硝基苯;由苯制环己烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
柠檬烯是一种食用香料,其结构简式如图。有关柠檬烯的分析正确的是( )
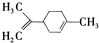
A.它的一氯代物有6种
B.它和丁基苯(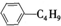 )互为同分异构体
)互为同分异构体
C.它的分子中所有的碳原子一定在同一平面上
D.一定条件下,它分别可以发生加成、取代、氧化、还原反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:填空题
观察下面几种烷烃的球棍模型


(1)与C互为同系物的是___________,与C互为同分异构体的是_______________。
(2)在烷烃的同系物中,随碳原子数增加,其熔、沸点依次_______(其中碳原子数满足______条件的烷烃常温下呈气态),液态时密度依次___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
(双选)两种气态烃以任意比例混合,在105℃ 时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是1OL,下列各组混合烃中不符合此条件的是( )
A.CH4、C2H4 B.CH4、C3H6 C.C2H4、C3H4 D.C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下甲烷课后作业化学试卷(解析版) 题型:选择题
下列化学式只表示一种纯净物的是( )
A.C2H6 B.C2H4Cl2 C.C5H12 D.C
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )
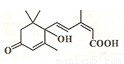
A.其分子式为C15H20O4
B.该物质含三种官能团
C.能发生加成反应、取代反应、氧化反应、酯化反应、加聚反应
D.1mol该物质与足量NaOH溶液反应,最多消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:实验题
【化工与技术--选作】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡 工业。某研究小组设计SnSO4制备路线如下:
工业。某研究小组设计SnSO4制备路线如下:
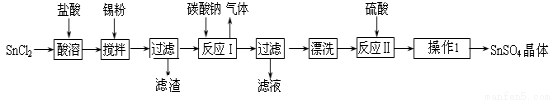
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119。
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
 (2)操作Ⅰ是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两 个:①调节溶液pH ② 。
个:①调节溶液pH ② 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl 2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:实验题
实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
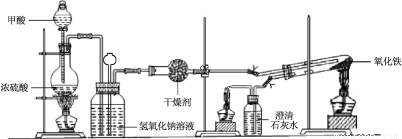

① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com