
| A. | C5H12 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中的阴离子肯定不存在金属元素 | |
| B. | 任何的阳离子只有氧化性,任何的阴离子只有还原性 | |
| C. | 与强酸、强碱都会反应的物质中只有两性氧化物或两性氢氧化物 | |
| D. | 根据化合物在水溶液中电离出的离子的类别,将化合物分为酸、碱、盐等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+ )=c(HSO3-) | B. | c(H2SO3)>c(SO32-) | ||
| C. | c(Na+ )=c(SO32-)+c(HSO3-) | D. | c(Na+ )+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
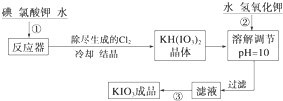
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、P、Mg的原子半径依次减小 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | HF、H2O、SiH4的稳定性依次减弱 | D. | HCl、HBr、HI的酸性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com