
(15分)银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
(1)脱水性(1分)
(2)恒压,使甲酸溶液能顺利滴下(2分)
(3)①对比试验,排除银氨溶液对产物检验的干扰(2分)
②(NH4)2CO3或NH4+、CO32—(2分)
(4)滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银。(4分)(试剂选对1个得1分,现象正确再得1分)
(5)①[Ag(NH3)2]++3H++Cl—=AgCl↓+2NH4+(2分) ②21.6(2分)
【解析】
试题分析:(1)甲酸在浓硫酸作用下生成一氧化碳,HCOOH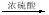 CO+H2O,依据反应特征分析可知浓硫酸表现的是脱水性;(2)软管的作用是使分液漏斗和试管A内气压相同,液体便于流下,故答案为:恒压,使甲酸溶液能顺利滴下;(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,是做对比实验,证明Ba(OH)2溶液不能与银氨溶液反应,证明实验b中的现象是产物与Ba(OH)2溶液反应导致的,答案为:对比试验,排除银氨溶液对产物检验的干扰;②a.测得上层清液pH为10,说明溶液显碱性;b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体,说明上层清液中含有铵根离子和碳酸根离子,答案为:(NH4)2CO3或NH4+、CO32-;(4)银可溶于浓硝酸,设计实验证明黑色固体是Ag单质的方法是取黑色固体溶解于浓硝酸溶液中生成红棕色气体二氧化氮和硝酸银溶液,加入氯化钠溶液生成白色沉淀氯化银说明黑色固体是单质银,答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银;(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。①生成AgCl沉淀的离子反应[Ag(NH3)2]++3H++Cl—=AgCl↓+2NH4+;②根据题给信息知,羟氨中氮元素为—1价,1mol羟氨被氧化为氮气转移1mol电子,若该反应中消耗6.6 g羟氨,根据电子守恒知,理论上可得银的物质的量为0.2mol,质量为21.6g。
CO+H2O,依据反应特征分析可知浓硫酸表现的是脱水性;(2)软管的作用是使分液漏斗和试管A内气压相同,液体便于流下,故答案为:恒压,使甲酸溶液能顺利滴下;(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,是做对比实验,证明Ba(OH)2溶液不能与银氨溶液反应,证明实验b中的现象是产物与Ba(OH)2溶液反应导致的,答案为:对比试验,排除银氨溶液对产物检验的干扰;②a.测得上层清液pH为10,说明溶液显碱性;b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体,说明上层清液中含有铵根离子和碳酸根离子,答案为:(NH4)2CO3或NH4+、CO32-;(4)银可溶于浓硝酸,设计实验证明黑色固体是Ag单质的方法是取黑色固体溶解于浓硝酸溶液中生成红棕色气体二氧化氮和硝酸银溶液,加入氯化钠溶液生成白色沉淀氯化银说明黑色固体是单质银,答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银;(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。①生成AgCl沉淀的离子反应[Ag(NH3)2]++3H++Cl—=AgCl↓+2NH4+;②根据题给信息知,羟氨中氮元素为—1价,1mol羟氨被氧化为氮气转移1mol电子,若该反应中消耗6.6 g羟氨,根据电子守恒知,理论上可得银的物质的量为0.2mol,质量为21.6g。
考点:考查化学实验方案的分析、评价和设计,根据信息书写方程式及电子守恒法计算。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是
A.X的氢化物溶于水生成弱酸
B.Z的氢化物的水溶液在空气中存放不易变质
C.Y与X可生成Y3X2型化合物
D.Z的单质在氧气中燃烧可以生成两种酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
(6分)将由 、
、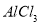 、
、 三种固体组成的 混合物溶于足量水,充分反应后得到
三种固体组成的 混合物溶于足量水,充分反应后得到 白色沉淀,向所得的浊液中逐滴加入
白色沉淀,向所得的浊液中逐滴加入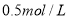 的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:

求:(1)分别求混合物中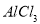 、
、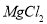 物质的量
物质的量
(2) 点时加入
点时加入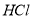 的体积(要求写出计算过程)
的体积(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
实验室中需要配制2mol/L的 溶液950mL,配制时应选用的容量瓶的规格和称取的
溶液950mL,配制时应选用的容量瓶的规格和称取的 质量分别是
质量分别是
A.950mL,111.2g B.500mL,117g
 C.1000mL,117g D.任意规格,111.2g
C.1000mL,117g D.任意规格,111.2g
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
“纳米材料”是粒子直径为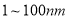 的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③⑤ C.②③④ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:选择题
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素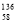 Ce、
Ce、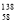 Ce、
Ce、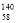 Ce、
Ce、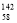 Ce,它们互为同素异形体
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑。
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:填空题
(13分)综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
A.可在酸性氧化物中寻找 B.可在碱性氧化物中寻找
C.可在ⅠA、ⅡA族元素形成的氧化物中寻找 D.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A: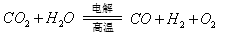 已知:
已知:
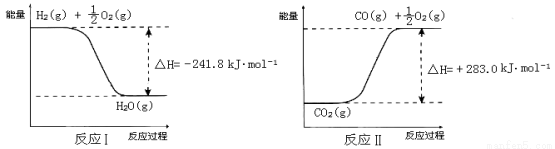
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
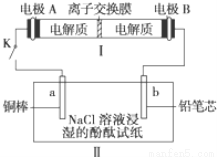
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时,先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2。
A.除②以外 B.除④以外 C.除⑤以外 D.全部正确
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是
A.Na+、H+、SO 、I- B.Na+、Ca2+、CO
、I- B.Na+、Ca2+、CO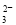 、Al3+
、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO 、Cl-、CO
、Cl-、CO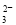
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com