
(1)25℃时,0.05 mol/L H2SO4溶液的pH=________;0.05 mol/L Ba(OH)2溶液中c(H+)=________.
(2)某温度下纯水中的c(H+)=2.0×10-7 mol/L,则此时溶液中的c(OH-)=________;若温度不变,滴入稀盐酸,使c(H+)=5.0×10-4 mol/L,则溶液中c(OH-)=________,此时溶液中由水电离产生的c(H+)=________.
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2015届山东省济宁市高二12月质检化学试卷(解析版) 题型:填空题
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH_____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(5) 25℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省德阳市高三“一诊”考试化学试卷(解析版) 题型:填空题
(10分)氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中
2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是 。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。
则该反应的热化学方程式是 。
(4)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
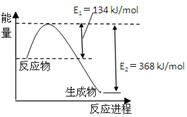
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=N2(g)+2CO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
查看答案和解析>>
科目:高中化学 来源:2012届新疆农七师高级中学高二下学期第一阶段考试化学试卷 题型:填空题
(4分)化学上常用电离度表示电解质的相对强弱:α=已电离的电解质分子数/溶液中原有电解质的总分子数×100%。
|
物质(微粒)及编号 |
电离度α |
|
A.硫酸溶液(第一步完全电离): HSO |
10% |
|
B.硫酸氢钠溶液:HSO |
29% |
|
CH3COOH |
1.33% |
|
D.盐酸:HCl=H++Cl- |
100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是_____(填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO的电离度,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年新疆农七师高级中学高二下学期第一阶段考试化学试卷 题型:填空题
(4分)化学上常用电离度表示电解质的相对强弱:α=已电离的电解质分子数/溶液中原有电解质的总分子数×100%。
| 物质(微粒)及编号 | 电离度α |
| A.硫酸溶液(第一步完全电离): HSO  H++SO H++SO | 10% |
B.硫酸氢钠溶液:HSO H++SO H++SO | 29% |
CH3 COOH COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D.盐酸:HCl=H++Cl- | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com