
| A. | 为测定熔融氢氧化钠的导电性,可在氧化铝坩埚中熔化氢氧化钠固体后进行测量 | |
| B. | Fe(OH)3胶体可以将Fe Cl3滴入NaOH溶液中进行制备 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
分析 A.氧化铝能和NaOH反应生成偏铝酸钠和水;
B.将饱和氯化铁溶液滴入沸水中制取氢氧化铁胶体;
C.Fe和NaOH溶液不反应,而Al和NaOH溶液反应生成偏铝酸钠和氢气;
D.能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,且能和稀盐酸生成二氧化碳的离子有碳酸根离子和碳酸氢根离子.
解答 解:A.氧化铝能和NaOH反应生成偏铝酸钠和水,所以不能用在氧化铝坩埚中熔化氢氧化钠固体,应该用Fe坩埚,故A错误;
B.氯化铁和NaOH溶液生成氢氧化铁沉淀而得不到氢氧化铁胶体,应该将饱和氯化铁溶液滴入沸水中制取氢氧化铁胶体,故B错误;
C.Fe和NaOH溶液不反应,而Al和NaOH溶液反应生成偏铝酸钠和氢气,所以可以用NaOH溶液除去Fe中的Al,然后过滤得到纯净的Fe,故C正确;
D.能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,且能和稀盐酸生成二氧化碳的离子有碳酸根离子和碳酸氢根离子,所以该溶液中不一定含有CO32-,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、除杂、物质制备等知识点,明确实验原理、物质性质是解本题关键,侧重考查实验评价、实验分析能力,注意除杂时不能引进新的杂质,题目难度不大.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ②④⑤ | C. | ①③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
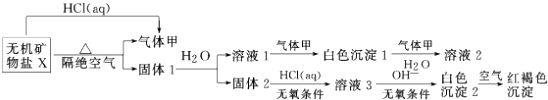
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 金属钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | Ba(OH)2溶液中滴加少量NH4HCO3溶液:NH4++HCO3-+2OH-+Ba2+=NH3•H2O+H2O+BaCO3↓ | |
| D. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 用聚乳酸塑料代替聚乙烯塑料能减少白色污染 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com