
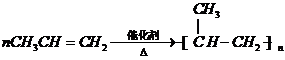 ,
, ,
, .
. 分析 (1)乙烯含有碳碳不饱和键,能和溴发生加成反应;
(2)实验室用碳化钙与水反应制备乙炔;
(3)丙烯发生加聚反应得到聚丙烯;
(4)苯在溴化铁作用下,能与液溴发生取代反应,生成溴苯和溴化氢;
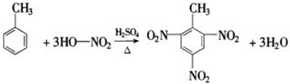
(5)甲苯的硝化反应:是在硫酸的催化作用下,与硝酸发生取代反应生成(TNT)2,4,6-三硝基甲苯和水.
解答 解:(1)含有不饱和键的有机分子能发生加成反应,有机物分子中的不饱和键断裂,断键原子与其它原子或原子团相结合,生成新的化合物,乙烯含有碳碳双键,能和溴反应生成1,2-二溴乙烷,化学方程式为Br2+CH2=CH2→BrCH2CH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(2)碳化钙与食盐水反应制备乙炔,该反应为CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)加聚反应是将含不饱和键的小分子在一定条件下反应得到分子量较大的大分子的反应.依据“双边单,两边伸,中括号,加上n”写出产物.加聚反应无副产物.丙烯在催化剂、加热的条件下,可生成聚丙烯.该反应为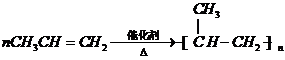
故答案为: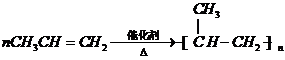
(4)苯在溴化铁作用下,能与液溴发生取代反应,生成溴苯和溴化氢.该反应为 .
.
故答案为: ;
;
(5)甲苯的硝化反应:是在硫酸的催化作用下,与硝酸发生取代反应生成(TNT)2,4,6-三硝基甲苯和水,该反应为 ,故答案为:
,故答案为: .
.
点评 本题考查了常见有机反应方程式的书写,题目难度不大,注意掌握常见的有机反应原理,注意有机物的官能团及特征反应,能够正确书写反应的化学方程式.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性和咸的食物 | |
| C. | 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
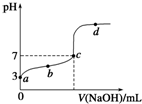 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的氢化物比同族氢化物的沸点均高 | |
| B. | X、Y、Z形成的化合物不止一种 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com