
下列说法正确的是( )
A.往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+
B.用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华
C.SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性
D.浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二下期末化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A. 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B. 纳米铁粉可以高效地去除被污染水体的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
C. 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
D. Ba2+浓度较高时危害健康,但BaSO4可服入体内,做为造影剂用于X-射线检查肠胃道疾病
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一下期末化学试卷(解析版) 题型:填空题
X、Y、Z、W、R是短周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 原子核内无中子 |
Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Z | 地壳中含量最高的元素 |
W | 原子质量数为23,中子数为12 |
R | 其离子是第三周期金属元素的离子中半径最小的 |
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是_____________(用元素符号表示)。
(2)Y2电子式为 ;X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是 (填共价或离子);X与Z形成的18e-微粒的结构式为 。
(3)砷(As)是人体必需的微量元素,与Y同一主族,A s原子比Y原子多两个电子层,则砷的原子序数为________,
s原子比Y原子多两个电子层,则砷的原子序数为________, 其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是__________________(用化学式表示)。
其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是__________________(用化学式表示)。
(4)W在元素周期表中的位置为_______;能够说明W和R金属性强弱的依据有 。
a.W单质的熔点比R单质的熔点低
b.W的化合价比R 的低
的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一下期末化学试卷(解析版) 题型:选择题
下列叙述或实验现象描述正确的是( )
A. 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性
B. 往足量铁与稀硝酸反应后的溶液中滴入KSCN溶液,溶液变为血红色
C. 往FeSO4溶液中通入NO2气体,溶液始终无明显现象
D. 往BaCl2溶液中通入SO2气体,无沉淀产生,再通NH3,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一下期末化学试卷(解析版) 题型:选择题
下列各组顺序的排列正确的是( )
A. 最高正化合价:F>O>N>C
B. 离子半径:F->O2->Na+>Al3+
C. 热稳定性:PH3<H2S<HCl<HF
D. 单质的还原性:Al>Mg>Na>K
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高一下期末化学试卷(解析版) 题型:选择题
下列有关概念的说法正确的是( )
A.H2、D2、T2互为同素异形体
B.甲烷和异丁烷互为同系物
C.14C和C60互为同位素
C.淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期末化学试卷(解析版) 题型:选择题
下列有机物的命名正确的是( )
A.二溴乙烷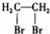
B.3﹣乙基﹣1﹣丁烯 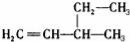
C.2﹣甲基﹣2,4﹣己二烯 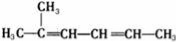
D.2,4,4﹣三甲基戊烷 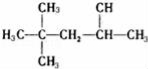
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期末化学试卷(解析版) 题型:填空题
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
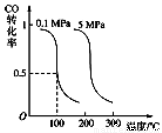
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率
(填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0. 2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。
(3)在D点,溶液中离子浓度大小关系为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com