
在500℃、101KPa条件下,将a mol SO2与b mol O2充入一容积可变的密闭容器中,达到平衡时SO3体积分数为40%,若温度和压强保持不变,平衡时密闭容器的容积为起始的_______倍。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
按要求填空:
(1)(9分)写出下列反应的化学方程式:
①实验室制取氨气 ___________________________________________
②浓硝酸的见光分解_______________________________________
③二氧化氮和水反应_______________________
(2)(10分)A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
A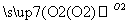 B
B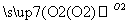 C
C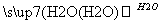 D
D
①若A、B、C、D均为含硫化合物,其中的B具有漂白性,而且它们的水溶液均能使湿润的蓝色石蕊试纸变红,则D为(填写化学式):______。写出B→C的化学方程式:_____________。
②若A是氢化物,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为______。写出A→B的化学方程式: ________________。
③若A为金属单质,组成元素的原子所含质子的数目小于18,D为强碱,写出C→D的化学方程式:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A | B | C | D | |
| 实验 | 用CCl4 提取溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
| 装置或仪器 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
日常所用干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-=Zn2+;2NH4++2 e-=2NH3+H2(NH3再用于结合Zn2+)。根据上述叙述判断下列说法中正确的是( )
A.干电池中Zn为正极,碳为负极
B.干电池工作时,电流由Zn极经外电路流向碳极
C.干电池长时间连续使用时内装糊状物可能流出腐蚀电器
D.干电池可以实现化学能向电能的转化和电能向化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
请根据反应 Fe + CuSO4 = Fe SO4 + Cu,设计原电池,完成以下问题。
负极: ,其电极反应式为:
正极|: ,其电极反应式为:________________________
电解质溶液: __________,电池的总离子反应式为:_
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.鸡蛋清溶液中加入醋酸铅溶液,会发生盐析
B.青苹果中富含苹果酸,因此苹果是酸性食物
C.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
D.氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药
查看答案和解析>>
科目:高中化学 来源: 题型:
降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=122.4kJ·mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示。
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
则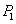 ______
______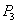 (填“>”“<”或“=”,下同)。若
(填“>”“<”或“=”,下同)。若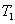 、
、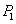 ,
,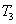 、
、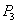 时平衡常数分别为
时平衡常数分别为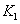 、
、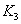 ,则K1_______K3。
,则K1_______K3。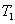 、
、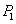 时H2的平衡转化率为________。
时H2的平衡转化率为________。
②一定条件下,上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是________。
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,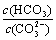 ________(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:_______。
________(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:_______。
a.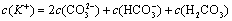
b.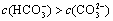
c.降低温度,c(H+)·c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息,判断以下叙述正确的是
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的稳定性为H2T<H2R B.单质与稀盐酸反应的剧烈程度为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com