
| A. | 5% | B. | 25% | C. | 17% | D. | 33% |
分析 在一定温度下,反应$\frac{1}{2}$H2(g)+$\frac{1}{2}$X2(g)?HX(g)的平衡常数为10,则HX(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$X2(g)的平衡常数为0.1,设HX的分解率为a,表示出平衡时各组分的物质的量,再根据K=$\frac{[{H}_{2}]^{\frac{1}{2}}×[{I}_{2}]^{\frac{1}{2}}}{[HI]}$列方程计算.
解答 解:在一定温度下,反应$\frac{1}{2}$H2(g)+$\frac{1}{2}$X2(g)?HX(g)的平衡常数为10,则HX(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$X2(g)的平衡常数为0.1,
设HX的分解率为a,则:
HX(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$X2(g)
起始量(mol):2 0 0
变化量(mol):2a a a
平衡量(mol):2-2a a a
容器的容积为1L,则K=$\frac{[{H}_{2}]^{\frac{1}{2}}×[{X}_{2}]^{\frac{1}{2}}}{[HX]}$=$\frac{\sqrt{a}×\sqrt{a}}{2-2a}$=0.1,解得a≈17%,
故选:C.
点评 本题考查化学平衡常数计算,注意对平衡常数表达式的理解,掌握三段式在化学平衡计算中应用.


科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
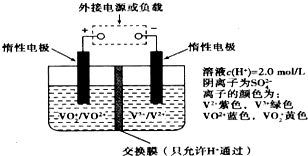 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )| A. | 充电过程中,H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 | |
| B. | 放电过程中,右槽溶液中溶液颜色由紫色变为绿色 | |
| C. | 该电池为可逆电池,当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 | |
| D. | 充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)增加了0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)??N2O4(g)△H<0 (红棕色) (无色) | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
| 甲 | 4mL | x mL | 1mL | 无 |
| 乙 | y mL | 2mL | 1mL | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K>$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向正反应方向移动 | |
| B. | K>$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向逆反应方向移动 | |
| C. | K<$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向正反应方向移动 | |
| D. | K<$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com