
| A. | 该溶液的pH小于7 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | D. | c(CH3COOH)<c(CH3COO-) |
分析 将0.2molCH3COONa晶体和0.1molHCl气体同时溶解于同一烧杯的水中,制得1L溶液,溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),则说明醋酸的电离程度大于醋酸根离子的水解程度.
解答 解:A.溶液中的溶质是醋酸钠和氯化钠、醋酸,且三者的物质的量浓度都是0.1mol/L,溶液中c(CH3COO-)>c(Cl-),则说明醋酸的电离程度大于醋酸根离子的水解程度,则溶液呈酸性,即溶液的pH小于7,故A正确;
B.根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.20mol•L-1,故B正确;
C.溶液中根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.20mol•L-1,且c(CH3COOH)<c(CH3COO-),所以c(CH3COO-)+c(OH-)>0.10mol•L-1,故C错误;
D.醋酸的电离程度大于醋酸根离子的水解程度,所以c(CH3COOH)<c(CH3COO-),故D正确;
故选C.
点评 本题考查离子浓度大小的比较,明确溶液中的溶质及其醋酸的电离程度大于醋酸根离子的水解程度是解本题关键,利用电荷守恒和物料守恒来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1mo N2(g)和1mo O2(g)完全反应放出的能量为180kJ | |
| B. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| C. | 1mol N2(g)和1molO2(g)具有的总能量小于2molN(g)具有的总能量 | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
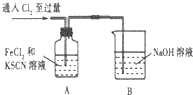 | 1.A中溶液变红 2.稍后,A中溶液由红色变为黄色 |
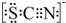 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
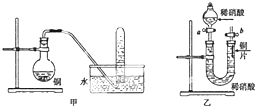 如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:
如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
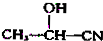 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$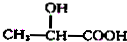
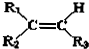 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$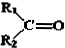 +
+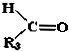
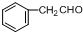 .现有如下转化关系:
.现有如下转化关系: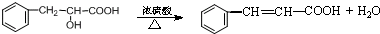 ;反应类型为消去反应;
;反应类型为消去反应;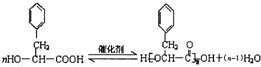 ;
;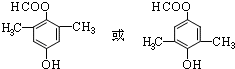 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Y的电离方程式为:H2Y+2H2O?2H3O++Y2- | |
| B. | 在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解方程式为HY-+H2O?H3O++Y2- | |
| D. | 在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
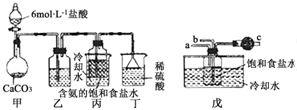 “侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:
“侯氏制碱法”是我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得NaHCO3,进而生产纯碱的一种化工方法.有关的化学反应方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com