
 如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )
如图为10mL一定物质的量浓度的盐酸(HCl),用一定浓度的NaOH溶液滴定的图示,依据图示推出HCl和NaOH的物质的量浓度是( )| 选项 | A | B | C | D |
| HCl物质的量浓度(mol/L) | 0.12 | 0.04 | 0.03 | 0.09 |
| NaOH物质的量浓度(mol/L) | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
| c(HCl).V(HCl)-c(NaOH).V(NaOH) |
| V(HCl)+V(NaOH) |
| c(HCl).V(HCl)-c(NaOH).V(NaOH) |
| V(HCl)+V(NaOH) |
| 3C(NaOH)×0.01L-C(NaOH)×0.02L |
| 0.01L+0.02L |
| c(HCl).V(HCl)-c(NaOH).V(NaOH) |
| V(HCl)+V(NaOH) |


科目:高中化学 来源: 题型:
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,因此可用做耐火材料 |
| B、氯气具有强氧化性,因此可用于漂白棉、麻、纸张 |
| C、氨很容易液化,因此可用作制冷剂 |
| D、某些金属或它们的化合物灼烧时有特殊的颜色,因此可用于制造烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液和AlCl3溶液 |
| B、FeBr2溶液和氯水 |
| C、NaHCO3溶液和澄清石灰水 |
| D、Ca(HCO3)2溶液和澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
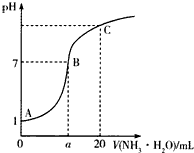 5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )
5℃时,在20mL的盐酸中,逐滴加入0.2mol?L-1的氨水,溶液的pH与氨水体积关系如图所示,则下列说法不正确的是( )| A、B点的横坐标a>10 |
| B、滴加前盐酸的物质的量浓度为0.1mol?L-1 |
| C、A、B间的任一点,溶液都有c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、如果将氨水换为NaOH溶液,则滴加20mL时溶液的pH一定大于C点的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子积是1.0×10-15 |
| B、温度改变,其离子积不变 |
| C、在液氨中加入NaNH2晶体,则c(NH4+)将减少,离子积不变 |
| D、在液氨中加入NH4Cl晶体,则c(NH4+)将增大,离子积增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、SO42-、Na+、NO3-、CO32- |
| C、Na+、HCO3-、NO3-、SO42- |
| D、Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:x>y |
| B、电负性:x>y |
| C、离子半径:x<y |
| D、第一电离:x<y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com