
【题目】A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,![]() 比
比![]() 少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得。请回答下列问题:
![]() 分子中心原子的杂化类型是 ______ 。
分子中心原子的杂化类型是 ______ 。
![]() 元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____、b:_____。
元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____、b:_____。

![]() 、D元素最高价氧化物对应的水化物的酸性强弱: ______
、D元素最高价氧化物对应的水化物的酸性强弱: ______ ![]() ______
______ ![]() 填化学式
填化学式![]() 。
。
![]() 用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
![]() 分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
【答案】![]()
![]() Au Cu
Au Cu ![]()
![]()
![]()
![]()
【解析】
A、B、C、D、E、F为前四周期的元素,其中,A元素和B元素的原子都有一个未成对电子,B原子得一个电子后3p轨道全充满,则B是Cl元素,![]() 比
比![]() 少一个电子层,则A是Al元素;C原子的p轨道中有3个未成对电子,则位于第VA族,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大,则C是N元素;D的最高化合价与最低化合价代数和为4,D为第VIA族元素,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池,则D是S元素;E元素的基态原子核外有六种运动状态的电子,有几种运动状态的电子则就有几个电子,则E是C元素;F元素的单质为红色固体,可通过“湿法冶金”而得,则F是Cu元素。
少一个电子层,则A是Al元素;C原子的p轨道中有3个未成对电子,则位于第VA族,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大,则C是N元素;D的最高化合价与最低化合价代数和为4,D为第VIA族元素,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池,则D是S元素;E元素的基态原子核外有六种运动状态的电子,有几种运动状态的电子则就有几个电子,则E是C元素;F元素的单质为红色固体,可通过“湿法冶金”而得,则F是Cu元素。
![]() 分子中心原子N形成3个
分子中心原子N形成3个![]() 键、还有1对孤电子对,所以N原子的杂化类型是
键、还有1对孤电子对,所以N原子的杂化类型是![]() ,
,
故答案为:![]() ;
;
![]() 是Cu元素,铜原子核外有29个电子,3d能级上排列10个电子,4s能级上排列1个电子,所以Cu元素的原子的外围电子排布式为
是Cu元素,铜原子核外有29个电子,3d能级上排列10个电子,4s能级上排列1个电子,所以Cu元素的原子的外围电子排布式为![]() ,Cu与Au以3:1形成的合金晶胞图,利用均摊法得,a的个数
,Cu与Au以3:1形成的合金晶胞图,利用均摊法得,a的个数![]() ,b的个数
,b的个数![]() =3,所以a表示Au原子,b表示Cu原子,
=3,所以a表示Au原子,b表示Cu原子,
故答案为:![]() ;Au Cu;
;Au Cu;
![]() 同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以Cl元素的非金属性大于S元素,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以酸性
同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以Cl元素的非金属性大于S元素,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以酸性![]() ,
,
故答案为:![]() ;
;![]() ;
;
![]() 用导线将Al和Cu的单质做成的电极连接起来,插入到盛有N的最高价氧化物的水化物的浓溶液(即浓硝酸)中构成原电池,常温下Al与浓硝酸发生钝化,形成致密的氧化膜,则铜作负极失去电子,铝作正极,Al极上硝酸根离子得电子发生还原反应生成NO2,电极反应式为
用导线将Al和Cu的单质做成的电极连接起来,插入到盛有N的最高价氧化物的水化物的浓溶液(即浓硝酸)中构成原电池,常温下Al与浓硝酸发生钝化,形成致密的氧化膜,则铜作负极失去电子,铝作正极,Al极上硝酸根离子得电子发生还原反应生成NO2,电极反应式为![]() ,
,
故答案为:![]() ;
;
![]() 分子R是由N元素与氢元素形成的18电子分子,R为
分子R是由N元素与氢元素形成的18电子分子,R为![]() ,R的电子式为
,R的电子式为![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:
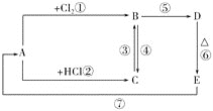
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、NaNO3 、K2SO3、Cu2O、FeO、Fe2O3中几种。为确定其组成,某同学进行如下实验:

已知: Cu2O+2H+= Cu2++Cu+ H2O
根据实验过程及现象,下列说法正确的是
A.无色气体A可用湿润的蓝色石蕊试纸检验
B.固体X中一定含有(NH4)2CO3、K2SO3、FeO
C.无色气体E一定含有CO2,一定不含SO2.
D.固体X中可能含有Cu2O、Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g) ΔH=+11kJ·mol-1,
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为___。若起始时n(HI)=100mol,则过程中需吸收的能量为___kJ。
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为___(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:
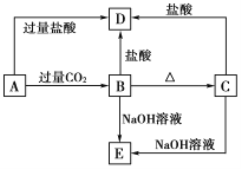
(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com