
| A. | 往溶液中通入氯气:Ca2+、CH3COO-、Br-、Na+ | |
| B. | 碱性溶液:Na+、SO42-、Cl-、ClO- | |
| C. | 加入浓盐酸的溶液:Fe2+、K+、NO${\;}_{3}^{-}$、NH4+ | |
| D. | 加入KSCN呈血红色的溶液:K+、Ca2+、Br-、HCO3- |
分析 A.氯气具有强氧化性,能够氧化溴离子;
B.四种离子之间不反应,都不与碱性溶液中的氢氧根离子反应;
C.硝酸根离子在酸性条件下能够氧化亚铁离子;
D.该溶液中存在铁离子,铁离子与碳酸氢根离子发生双水解反应.
解答 解:A.Br-能够被氯气氧化,在溶液中不能大量共存,故A错误;
B.碱性溶液中存在大量氢氧根离子,Na+、SO42-、Cl-、ClO-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.Fe2+、NO3-在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.加入KSCN呈血红色的溶液中存在铁离子,HCO3-与铁离子发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
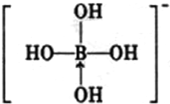 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素只能组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某有机物分子的比例模型(填充模型),其中○代表氢原子,
如图是某有机物分子的比例模型(填充模型),其中○代表氢原子, 表示碳原子,
表示碳原子, 代表氧原子.该有机物的名称是( )
代表氧原子.该有机物的名称是( )| A. | 乙烷 | B. | 乙烯 | C. | 乙酸 | D. | 乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com