
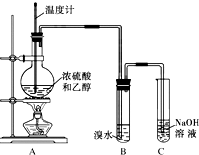
 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.分析 (1)根据题中实验目的和实验装置可知,乙醇在浓硫酸作用下加热发生消去反应得乙烯,乙烯通过溴水溶液,与溴发生加成反应得1,2-二溴乙烷,给液体加热要加入沸石,防止瀑沸,溴水的溴易挥发,所以尾气要用氢氧化钠溶液吸收;
(2)浓硫酸具有脱水性,在加热时容易使乙醇脱水生成碳,碳中加热时可与浓硫酸发生反应生成二氧化碳和二氧化硫,乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃还可以生成乙醚,乙烯通入速率过快也会使消耗乙醇量增加;
(3)要验证生成的气体与溴水的反应是加成而不是取代,在A、B之间增加一个装有烧碱溶液的洗气装以除去发生装置中产生的二氧化硫等酸性气体对实验的干扰,然后用pH试纸来测试反应后B中溶液的酸性即可验证,如果B中溶液的酸性增强,则发生了取代反应,如果B中溶液的酸性没有明显增强,则发生加成反应,结合(2)的分析进行答题.
解答 解:(1)根据题中实验目的和实验装置可知,乙醇在浓硫酸作用下加热发生消去反应得乙烯,反应的方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,乙烯通过溴水溶液,与溴发生加成反应得1,2-二溴乙烷,反应的方程式为CH2=CH2+Br2 →CH2BrCH2Br,给液体加热要加入碎瓷片(或沸石),防止瀑沸,溴水的溴易挥发,所以尾气要用氢氧化钠溶液吸收,防止污染空气,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2 →CH2BrCH2Br;碎瓷片(或沸石);吸收尾气,防止污染;
(2)①浓硫酸具有脱水性,在加热时容易使乙醇脱水生成碳,所以乙同学观察到的黑色物质是碳,碳加热时可与浓硫酸发生反应生成二氧化碳和二氧化硫,其中二氧化硫有刺激性气味,
故答案为:C;SO2;
②乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃还可以生成乙醚,乙烯通入速率过快也会使消耗乙醇量增加,
故答案为:乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃可以生成乙醚、乙烯通入速率过快;
(3)要验证生成的气体与溴水的反应是加成而不是取代,在A、B之间增加一个装有烧碱溶液的洗气装以除去发生装置中产生的二氧化硫等酸性气体对实验的干扰,然后用pH试纸来测试反应后B中溶液的酸性即可验证,如果B中溶液的酸性增强,则发生了取代反应,如果B中溶液的酸性没有明显增强,则发生加成反应,根据(2)①中的分析可知,烧瓶内混合液在实验过程中可能还有另外两种气体产生,这两种气体是CO2、SO2,
故答案为:除去二氧化硫等酸性气体;如果发生了取代反应,则B中溶液的酸性增强;CO2、SO2.
点评 本题考查了物质组成成份的实验方案设计和分析判断,主要考查乙醇、乙烯、碳、浓硫酸等物质的性质应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验方案 | ② | ④ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4中溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 | 略 |
2 | 向含酚酞的NaOH溶液中,各滴加等量②③两 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的溶液的酸性 | 略 | CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:由强到弱顺序(填序号) | |||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com