
【题目】在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-的浓度分别为A mol/L与B mol/L,则A和B的关系为( )
A.A>BB.A=10-4BC.B=10-6AD.A=B
【答案】B
【解析】
酸或碱抑制水电离,含有弱根离子的盐促进水电离,pH=9的氢氧化钠和乙酸钠,乙酸钠促进水电离,氢氧化钠抑制水电离,NaOH溶液中水电离出的c(OH-)=c(H+),醋酸钠溶液中水电离出的c(OH-)=![]() 。
。
在pH等于9的NaOH溶液中,c(H+)=1×10-9mol/L,而NaOH只能提供OH-,不提供H+,根据公式知:由NaOH电离产生的c(OH-)=![]() =10-5mol/L,则由水电离产生的c(OH-)=c(H+)=
=10-5mol/L,则由水电离产生的c(OH-)=c(H+)=![]() mol/L=10-9mol/L,即A=10-9mol/L;CH3COONa是弱酸强碱盐,水中乙酸根离子水解呈碱性,促进水的电离,pH=9的CH3COONa溶液促进水的电离,OH-全部由水电离产生,c(OH-)=10-5mol/L,即B= c(OH-)=10-5mol/L,所以A:B=10-9mol/L:10-5mol/L=10-4,即A=10-4B,故合理选项是B。
mol/L=10-9mol/L,即A=10-9mol/L;CH3COONa是弱酸强碱盐,水中乙酸根离子水解呈碱性,促进水的电离,pH=9的CH3COONa溶液促进水的电离,OH-全部由水电离产生,c(OH-)=10-5mol/L,即B= c(OH-)=10-5mol/L,所以A:B=10-9mol/L:10-5mol/L=10-4,即A=10-4B,故合理选项是B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它与水互溶并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如图所示(反应条件没有全部注明),请回答:
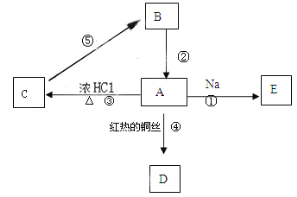
(1)有机物A的官能团名称是_______,该官能团的电子式是______。
(2)反应③的反应类型是________。
(3)反应④的化学方程式是_______。
(4)反应⑤的化学方程式是______。
(5)下列说法正确的是_______
A.反应①中Na与A的反应比Na与H2O反应更剧烈
B.反应⑤的反应类型是消去反应
C.有机物A可以使酸性高锰酸钾褪色
D.有机物B不能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸又称安息香酸,结构简式为![]() ,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
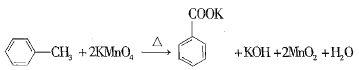
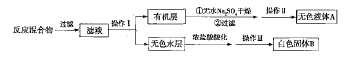
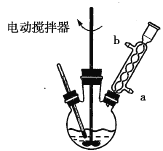
实验时,将一定量的甲苯和高锰酸钾溶液置于图示装置中,在100℃下反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
熔点/℃ | 122.4 |
沸点/℃ | 249 |
密度/( | 1.2659 |
水溶性 | 微溶 |
(1)实验中用电动搅拌器进行搅拌的目的是________________。
(2)冷凝管中冷却水是从________(填“a”或“b”)口进入。
(3)操作Ⅰ的名称是,所需的玻璃仪器有________、烧杯;操作Ⅱ的名称是________。
(4)水层用浓盐酸酸化的相关化学方程式为_________________。
(5)如果滤液呈紫色,则要先加入还原剂亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________________。
(6)无色液体A的主要成分是________,白色固体B的主要成分是________。
(7)为测定所得产品的纯度,称取1.220g产品,配成![]() 溶液,取其中
溶液,取其中![]() 溶液进行滴定,消耗
溶液进行滴定,消耗![]() 的物质的量为
的物质的量为![]() ,则产品中苯甲酸的质量分数为________。
,则产品中苯甲酸的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是( )
A.在催化剂存在条件下苯与溴反应制溴苯
B.ClCH2CH=CH2+NaOH![]() HOCH2CH=CH2+NaCl
HOCH2CH=CH2+NaCl
C.乙酸乙酯在碱性条件下水解
D.在一定条件下苯与氢气反应制环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )。
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.分子式符合![]() 的化合物有6种
的化合物有6种
C.已知二氯苯有3种结构,则四氯苯也有3种结构
D.菲的结构简式为 ,一定条件下,它与硝酸反应,可生成5种一硝基取代物
,一定条件下,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%![]() 溶液洗涤,最后再用蒸馏水洗涤;
溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水![]() 干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
请回答下列问题:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作的注意事项是_______________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是___________________________________。
(3)步骤④中洗涤粗硝基苯应使用的仪器是___________________________________________________。
(4)步骤④中粗产品用5%![]() 溶液洗涤的目的是___________________________________________。
溶液洗涤的目的是___________________________________________。
(5)纯硝基苯是无色、密度比水_______________________________(填“小”或“大”)的油状液体,它具有________味。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如图所示:

(1)化合物A的分子式是___;A中含有的官能团的名称是___。
(2)A、B、C、D四种化合物中互为同分异构体的是___。(填序号)
(3)化合物B的核磁共振氢谱中出现___组峰。
(4)1molD最多能与___mol的氢气发生加成反应;1molD与足量Br2水混合,最多能和___ molBr2发生反应
(5)已知C的一种同分异构体满足:①能够发生水解反应;②能够发生银镜反应;③能够使FeCl3溶液显紫色;④苯环上的一氯代物有2种。请写出它的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮(水中以NH3和NH4+形式存在的氮)含量是环境水体污染的一项重要指标,其氧化过程会造成水体中溶解氧浓度降低,导致水质下降,影响水生动植物的生长。
(1)水中NH3和NH4+两者的浓度比取决于水体的pH和水温。当pH偏高时,___比例较高,原因是___(请用离子方程式表示)。
(2)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH充分反应后,再向水中通入空气,可增大NH3的脱除率,用平衡移动原理解释其原因:___。
(3)在微生物作用下,蛋白质在水中分解产生的NH3能够被O2氧化生成亚硝酸(HNO2)。
___NH3+__O2→__HNO2+__________
①请将上述化学方程式补充完整,并配平。
②反应中氧化剂与还原剂的物质的量之比为___。
③若反应中有0.6mol电子发生转移,生成亚硝酸的质量为___。
(4)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示。DO的测定原理如下:
①2Mn2++O2+4OH-→2MnO(OH)2↓
②MnO(OH)2+2I-+4H+→Mn2++I2+3H2O
③2S2O32-+I2→S4O62-+2I-
某小组同学取100.00mL水样经反应①和②后,取出20.00mL溶液,以淀粉作指示剂,用amol/LNa2S2O3溶液进行滴定,终点现象为___;滴定消耗Na2S2O3溶液bmL,水样的DO=____mg/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com