
| A. | 0.3mol NO2 | B. | 0.3mol NO、0.1mol NO2 | ||
| C. | 0.6mol NO | D. | 0.3mol NO2、0.1mol NO |
分析 11.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成硝酸铁、硝酸铜,向所得溶液中加入足量的NaOH溶液,生成21.4g沉淀为氢氧化铁、氢氧化铜的总质量,则沉淀中氢氧根的质量=21.4g-11.2g=10.2g,根据电荷守恒可知,金属提供电子物质的量等于氢氧根物质的量,根据电子转移守恒计算判断.
解答 解:11.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成硝酸铁、硝酸铜,向所得溶液中加入足量的NaOH溶液,生成21.4g沉淀为氢氧化铁、氢氧化铜的总质量,则沉淀中氢氧根的质量=21.4g-11.2g=10.2g,n(OH-)=$\frac{10.2g}{17g/mol}$=0.6molmol,根据电荷守恒可知,金属提供电子物质的量等于氢氧根物质的量,即金属提供电子物质的量为0.6mol,
A.若生成0.3mol NO2,则转移电子为0.3mol×(5-4)=0.3mol,电子转移不守恒,故A错误;
B.若生成0.3mol NO、0.1mol NO2,则转移电子为0.3mol×(5-2)+0.1mol×(5-4)=1mol,电子转移不守恒,故B错误;
C.若生成0.6mol NO,则转移电子为0.6mol×(5-2)=1.8mol,电子转移不守恒,故C错误;
D.若生成0.3mol NO2、0.1mol NO,则转移电子为0.3mol×(5-4)+0.1mol×(5-2)=0.6mol,电子转移守恒,故D正确,
故选D.
点评 本题考查混合物有关有关计算,关键是判断金属提供电子物质的量等于氢氧根物质的量,注意守恒思想的应用,难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | O2和O3 | B. | ${\;}_{1}^{2}$H和${\;}_{1}^{2}$H | ||
| C. | 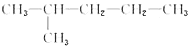 和CH3-CH2-CH2-CH2-CH2-CH3 和CH3-CH2-CH2-CH2-CH2-CH3 | D. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色保持不变 | |
| B. | 体系的平均相对分子质量保持不变 | |
| C. | NO2和SO2的体积比保持不变 | |
| D. | 每消耗1 mol SO2的同时生成1 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.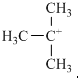 ,它是有机反应中重要的中间体,
,它是有机反应中重要的中间体,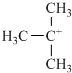 失去一个H+后将生成B的同系物F,F的结构简式为
失去一个H+后将生成B的同系物F,F的结构简式为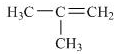 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
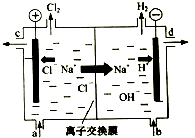 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用待装溶液润洗 | |
| B. | 碱式滴定管未用待装溶液润洗 | |
| C. | 滴定达终点时,仰视滴定管内液体的凹面的最低点 | |
| D. | 在滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:②>③>①>④ | B. | 原子半径:④>③>②>① | ||
| C. | 电负性:②>③>①>④ | D. | 最高正化合价:②>③>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水可以区分苯和CCl4 | |
| B. | 有机物分子中都存在碳碳单键 | |
| C. | 做银镜反应实验后的试管内壁附有银,可用稀盐酸清洗 | |
| D. | 检验乙醇消去后的产物乙烯,可将气体直接通入酸性高锰酸钾溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com