
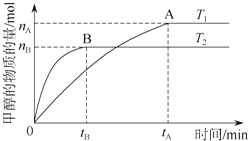
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:分析 (1)根据图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(2)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答.
解答 解:(1)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大;
①v(CH3OH)=$\frac{\frac{{n}_{A}}{2L}}{{t}_{A}}$=$\frac{{n}_{A}}{2{t}_{A}}$mol/L•min,故①错误;
②正反应为放热反应,根据题给图象分析可知,T2先达到平衡则T2>T1,升高温度,平衡向逆反应方向移动,该反应在T1时的平衡常数比T2时的大,故②错误;
③依据图象分析T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2?CH3OH+H2O向逆反应方向移动,故正反应为放热反应,故③正确;
④处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故④正确;
故答案为:③④;
(2)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 1 3 0 0
变化 α 3α α α
平衡 1-α 3-3α α α
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:$\frac{2-α}{2}$.
点评 本题主要考查了 图象分析判断,反应速率、化学平衡等重要知识,难度中等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | B. | 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | ||
| C. | 2Mg+CO2═C+2MgO | D. | CO+H2O(g)═CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$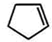 +NaCl+H2O;反应的化学方程式:
+NaCl+H2O;反应的化学方程式: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl+H2O.
+NaCl+H2O.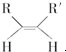 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式:
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式: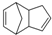 $\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$ ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
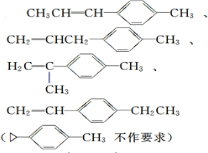
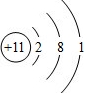 .
. .
.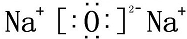 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.250 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年诺贝尔化学奖授予发明超分辨屏荧光显微镜的科学家,他们使光学显微镜分屏率提高到纳米尺度.利用超分辨率荧光显微镜可以观察到胶体中的胶粒 | |
| B. | 人体从食物中摄取蛋白质,在体内先水解成各种氨基酸,经过不断的分解,最终生成水和二氧化碳排除体外 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 我国油品从国四汽油升级到国v汽油,有助于减少酸雨、雾霾,提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
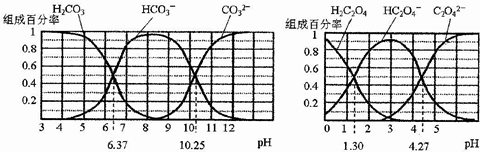
| A. | 在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| C. | 加快开发高效洁净能源转换技术,缓解能源危机 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com