
| A. | 核外电子排布为1s22s22p43s2的原子处于激发态 | |
| B. | 某元素质量数51,中子数28,其基态原子中未成对电子数为1 | |
| C. | 若某基态原子的外围电子排布为4d15s2,该元素原子核外有5个电子层 | |
| D. | BF3中B原子sp2杂化,为平面三角形 |
分析 A.基态原子电子排布时应该先排布2p轨道,再排3s轨道;
B.质量数51,中子数28,则该元素原子的质子数为51-28=23,根据核外电子排布规律书写基态原子的电子排布式;
C.根据外围电子排布的主量子数判断;
D.根据B原子的价层电子对数判断.
解答 解:A.基态原子电子排布时应该先排布2p轨道,再排3s轨道,则基态核外电子排布为1s22s22p6,所以核外电子排布为1s22s22p43s2的原子处于激发态,故A正确;
B.质量数51,中子数28,则该元素原子的质子数为51-28=23,故该元素基态原子的电子排布式为:1s22s22p63s23p63d34s2,3d能级具有5个轨道,3个电子优先分别占据1个轨道,且自旋方法相同,故有3个成对电子,故B错误;
C.若某基态原子的外围电子排布为4d15s2,其主量子数为5,所以该元素原子核外有5个电子层,故C正确;
D.BF3中B原子的价层电子对数为3+$\frac{1}{2}$(3-3×1)=3,属于sp2杂化,没有孤电子对,分子构型为平面三角形,故D正确.
故选B.
点评 本题考查了核外电子排布、杂化类型和分子构型的判断,题目难度中等,侧重于考查学生对基础知识的应用能力,注意把握价层电子对数的判断方法.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O | |
| B. | Ag+2HNO3(浓)→AgNO3+NO2↑+H2O | |
| C. | C+2H2SO4(浓)→CO2↑+2SO2↑+2H2O | |
| D. | 3Fe3O4+28HNO3(浓)→9Fe(NO3)3+NO↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
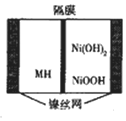 一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )
一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )| A. | 隔膜为阴离子交换膜 | |
| B. | 电池的电解液可为硫酸 | |
| C. | 充电时阳极反应为H2O+M+e-═MH+OH- | |
| D. | 放电时负极反应为Ni(OH)2+OH--e-═NiOOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g乙醇含有的C-H键数为0.6NA | |
| B. | 2gD216O含有的质子数和中子数均为NA | |
| C. | 每生成1molO2,转移的电子数一定为4NA | |
| D. | 标准状况下,22.4L NO与11.2L O2充分反应,产物分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
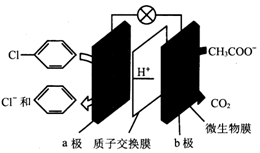
| A. | 该装置能将化学能转化为电能 | |
| B. | a极发生还原反应 | |
| C. | b极电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+ | |
| D. | 每除去1mol氯苯,电路中转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-121.5kJ•mol-1 | |
| B. | 2CO2(g)+3H2(g)═$\frac{1}{2}$CH3OCH3(g)+$\frac{3}{2}$H2O(g)△H=-25.5kJ•mol-1 | |
| C. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=+121.5kJ•mol-1 | |
| D. | 2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-72.5kJ•mol-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
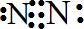 ;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D
;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混合物溶于水 | B. | 将混合物加热使碘升华 | ||
| C. | 将混合物倒入NaOH溶液 | D. | 将混合物倒入酒精中充分溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com