
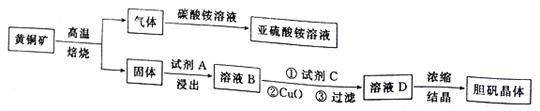
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________。
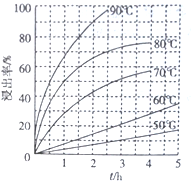
(2)最适合的试剂A是__________(写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________。
(3)最适合的试剂C是__________(填标号)。
a.Cl2b. H2O2 溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________,Fe3+沉淀完全时溶液的pH 为__________。通过计算判断加入CuO__________(填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________(写出原始的计算结果即可,不必化简)。
【答案】 -2 SO2+(NH4)2CO3=(NH4)2SO3+CO2 H2SO4 90℃、2 h b 2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ 4.0 3.0 能  ×100%
×100%
【解析】(1)CuFeS2中铜的化合价为+2价,铁的化合价为+2价,根据元素化合价代数和为零可知硫的化合价为-2价;上述流程中黄铜矿高温焙烧产生的气体是二氧化硫,二氧化硫与碳酸铵反应生成亚硫酸铵和二氧化碳,反应的化学方程式为:SO2+(NH4)2CO3=(NH4)2SO3+CO2;(2)以黄铜矿为原料制取胆矾晶体,焙烧后生成的氧化物必须先用硫酸溶解,故最适合的试剂A是H2SO4;由图中信息可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为:90℃、2h;(3)试剂C是将溶液B中的亚铁离子氧化为铁离子,在加入氧化铜调节pH值后水解转化为沉淀而除去铁,最适合的试剂C是H2O2 溶液,将亚铁离子氧化为铁离子的同时产生水,没有引入新的杂质,答案选b;(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解生成氢氧化铁,同时氧化铜溶解生成Cu2+,达到除杂的目的。实现该目的的总反应的离子方程式为:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+;(5)常温下Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=3.0 mol·L-1×c2(OH-)=3.0×10-20,则c(OH-)=1.0×10-10,c(H+)=1.0×10-4,pH=4.0,即Cu2+开始沉淀时溶液的pH 为4.0;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全,Ksp[Fe(OH)3] =c(Fe3+)c3(OH-)=1.0×10-5 mol·L-1×c3(OH-)=8.0×10-38,则c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH=3.0,由于Cu2+开始沉淀时溶液的pH 为4.0,Fe3+沉淀完全时溶液的pH 为3.0,加入CuO能达到目的;(6)根据铜的质量守恒黄铜矿和加入的氧化铜中的铜的总质量先于胆矾晶体中铜的总质量,黄铜矿中CuFeS2的质量分数为x,则有:cg×x×![]() +ag×
+ag×![]() =bg,解得x=
=bg,解得x=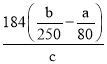 ×100%。
×100%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJmol﹣1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJmol﹣1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJmol﹣1
则14g CO气体与足量FeO充分反应得到Fe单质和CO2气体时的释放或吸收的热量为( )
A.放出218 KJ
B.放出109kJ
C.吸收218 kJ
D.吸收109 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方大部分地区出现严重空气污染,其主要原因是化石燃料的大量使用。提高利用率,减少化石燃料燃烧所造成的环境污染,已成为人类面临的重大挑战。
(1)氢气是人类理想的能源。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发且比较经济的制氢气的方法是________(填序号)。
①电解水 ②锌与稀硫酸反应 ③光解海水
制得氢气后还需要解决的问题是____(写出其中一个)。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
葡萄糖
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2===CH2+4H2O
CH2===CH2+4H2O
以上反应中,最节能的是________,原子利用率最高的是________。
(3)煤液化后可得到甲醇,甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚反应可生成高分子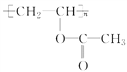 ,写出A的结构简式_________________。
,写出A的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ ![]() O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)也可将CH4设计成燃料电池,来解决能源问题,如下图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。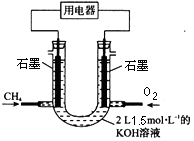
①0<V≤33.6L时,负极电极反应为。
②V=44.8L时,溶液中离子浓度大小关系为。
(3)工业合成氨时,合成塔中每产生1molNH3 , 放出46.1kJ的热量。
某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系 | ||
N2 | H2 | NH3 | |||
① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
② | 2 | 8 | 0 | t2 min | 放出热量:Q |
①容器①中,0-t1时间的平均反应速率为υ(H2)=。
②下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(4)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。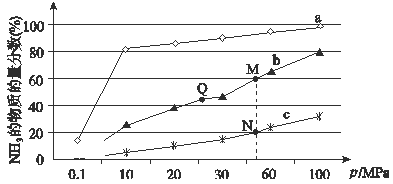
①曲线a对应的温度是。
②上图中M、N、Q点平衡常数K的大小关系是 。
③M点对应的H2转化率是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机物A的结构,进行如下实验. [分子式的确定]
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成9.0g H2O和17.6g CO2 , 消耗氧气13.44L(标准状况下).则该物质的最简式是 , 能否据此确定该有机物的分子式(若能则写出其分子式,若不能请说明理由)
(2)根据价键理论,预测A可能的结构种(不考虑立体异构).
(3)[结构式的确定] 经测定,有机物A分子内有2种不同环境的氢原子,且A能与金属钠反应放出气体,则A的结构简式为 .
(4)[性质实验] A在一定条件下脱水可生成B,B可发生加聚反应生成C,请写出A转化为B的化学反应方程式: .
(5)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请选用B的某同系物和其他试剂及合适的方法制备氯乙烷,要求原子利用率为100%,写出制备反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以硫酸钡不是电解质
B.NaCl溶液能导电,所以NaCl溶液是电解质
C.氯化氢溶于水能导电,所以盐酸是电解质
D.固态的NaCl不导电,熔融态NaCl可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4 , 其流程如下: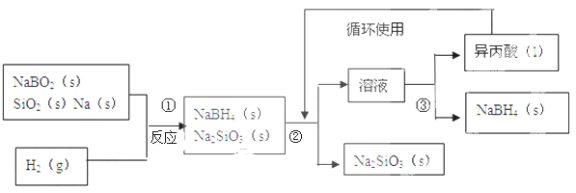
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等;
(2)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)第②步分离采用的方法是 ;第③步分离(NaBH4)并回收溶剂,采用的方法是 .
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
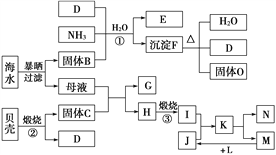
结合上述工艺流程图回答下列问题:
(1)物质G和L的化学式分别为________和________________。
(2)上述工艺流程图中可以循环使用的物质的化学式为______。
(3)反应①的化学方程式为______________________________;在反应①中必须先通入NH3,而后通入D,其原因是____________________。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为________________。
(5)由K溶液经如何处理才能制得N?_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com