
在一容积可变的密闭容器中,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减小了 D.化学计量数关系a>b
科目:高中化学 来源: 题型:
如图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。装置Ⅰ的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为:2Na2S2+NaBr3 Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确( )。
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确( )。
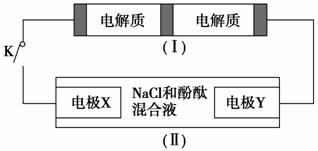
A.闭合开关K时,钠离子从右到左通过离子交换膜
B.闭合开关K时,负极反应式为:3NaBr-2e-===NaBr3+2Na+
C.闭合开关K时,X电极反应式为:2Cl--2e-===Cl2↑
D.闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
用铁酸钠(Na2FeO4)对河湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是( )
A.Na2FeO4在溶液中显强酸性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的还原产物Fe3+易水解为Fe(OH)3胶体,可使水中悬浮物凝聚沉降 D.Na2FeO4的还原产物Fe2+易水解为Fe(OH)2胶体,可使水中悬浮物凝 聚沉降
聚沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
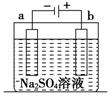
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
(1)此时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)若恒容下升高温度,则混合气体的相对分子质量 ;
密度 。(填“变大”“变小”或“不变”)。
(3)若充入氩气,并保持压强不变,平衡将 ;(填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热, 加热使容器内温度迅速升至原来的2倍,达到新平衡后,
容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类合理的是
A.氧化物:CO2 NO SO2 H2O
B.碱:NaOH KOH Ba(OH)2 Na2CO3
C.铵盐:NH4Cl NH4NO3 (NH4)2SO4 NH3·H2O
D.酸:NaHSO3 HCl H2SO4 HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2Al+Fe2O3 2Fe+Al2O3,其中Fe2O3是
2Fe+Al2O3,其中Fe2O3是
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com