
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 | |
| D. | 2V正(CrO42-)=V逆(Cr2O72-)时,反应处于平衡态 |
分析 A.存在平衡:2Cr O42-(黄色)+2H+?Cr2O42-(橙色)+H2O,如颜色不变,则达到平衡状态;
B.若1L酸化后所得溶液中含铬元素的质量为28.6g,根据守恒列关系式:2Cr~2CrO42-~Cr2O72-~2Cr3+~6e-~6FeSO4•7H2O计算;
C.酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有$\frac{10}{11}$转化为Cr2O72-,说明铬元素有$\frac{10}{11}$转化为Cr2O72-,计算平衡浓度,结合平衡常数计算;
D.不同物质的正逆反应速率之比等于化学计量数之比,则反应达到平衡.
解答 解:A.平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故A正确;
B.若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,设需要xmolFeSO4•7H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),x=1.65,m(FeSO4•7H2O)=1.65mol×278g/mol=458.7g,故B正确;
C.1L废水中n(Cr)=$\frac{28.6g}{52g/mol}$=0.55mol,CrO42-有$\frac{10}{11}$转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-$\frac{10}{11}$)=0.05mol/L,c(Cr2O72-)=0.55mol/L×$\frac{10}{11}$×$\frac{1}{2}$=0.25mol/L,常温下转化反应的平衡常数K=1×1014,则$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}){c}^{2}({H}^{+})}$=1×1014,c(H+)=1×10-6mol/L,所以pH=6,故C正确;
D.不同物质的正逆反应速率之比等于化学计量数之比,则反应达到平衡,则V正(CrO42-)=2V逆(Cr2O72-)时,反应处于平衡态,故D错误;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol SiO2中共价键总数为2NA | |
| B. | 常温下,64g NO2中含质子总数为23NA | |
| C. | 标准状况下,22.4L丙烯和环丙烯的混合气体中氢原子个数为0.2NA | |
| D. | 0.2mol Fe在0.2mol Cl2中燃烧失去的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸溶液,NaAlO2溶液 | B. | 浓氨水,AgNO3溶液 | ||
| C. | NaOH溶液,AlCl3溶液 | D. | Cu,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
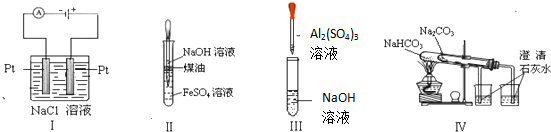
| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| C. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 | |
| D. | 除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 序号 | 初始浓度c/(mol•L-1) | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 1.60 | 0.40 | 0.0020 | 580 |
| ② | 3.20 | 0.40 | 0.0020 | 290 |
| ③ | 1.60 | 0.80 | 0.0020 | 290 |
| ④ | 1.60 | 0.40 | 0.0040 | 1160 |
| A. | 由①④实验对比,可以得出增大c(Br2),v(Br2)减小 | |
| B. | 由②③实验对比,可以得出实验②和③的v(Br2)相等 | |
| C. | 由①③实验对比,可以得出增大c(HCl),v(Br2)增大 | |
| D. | 由①②实验对比,可以得出增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a大于0,P1小于P2 | |
| B. | M点H2O(g)的转化率为10% | |
| C. | M点化学反应速率大于N点 | |
| D. | 250℃时,用平衡分压计算的化学平衡常数 KP=$\frac{9}{16}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com