
铅蓄电池放电时发生下列变化: 负极:Pb +SO42―-2 e == PbSO4↓
正极:PbO2 + 4H+ + SO42―+ 2 e ==PbSO4↓+ 2H2O 使用该电池电解
CuSO4溶液,要得到纯铜1.6g,这时铅蓄电池消耗H2SO4的物质的量为
A. 0.025mol B. 0.05mol C.0.1mol D. 0.2mol
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
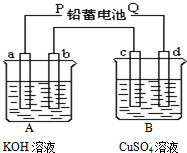 如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.
如图装置实验,A、B两烧杯分别盛放200g10%KOH和足量CuSO4溶液.通电一段时间后,c极增重3.2g.查看答案和解析>>
科目:高中化学 来源:河北省秦皇岛一中2008-2009学年高二下学期第二次月考化学试题 题型:038
如图所示,常温下电解5 min后,铜电极质量增加2.16 g.
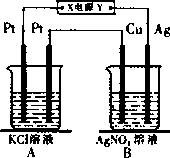
试回答:
(1)电源电极X名称为________(填“正极”或“负极”).
(2)若A中KCl溶液的体积是200 mL,电解后溶液的PH=________(忽略电解前后溶液体积的变化).
(3)若要使电解后的溶液恢复到与电解前完全相同,应加入________.
(4)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
这时电池内消耗的H2SO4的物质的量至少是________mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com