
分析 根据氧化还原反应中电子得失守恒和元素守恒配平化学方程式,根据化合价的升降判断氧化剂,并计算出电子转移数目,由此分析解答.
解答 解:在硝酸铁、氢氧化钠和氯气的反应中,铁元素从+3价变为+6价,氯元素从0价变为-1价,根据氧化还原反应中电子得失守恒和元素守恒配平后的化学方程式为2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O,在这个反应中氯元素从0价变为-1价,所以氯气为氧化剂,铁元素从+3价变为+6价,所以2mol Fe (NO3)3参加反应时可转移电子数为6mol,则1mol Fe (NO3)3参加反应时转移电子数为3mol,故答案为:2、16、3、2、6、6、8,3.
点评 本题考查氧化还原反应的书写和电子转移数目的计算,学生在要学会化合价升降在氧化还原反应配平中的应用,中等难度.


科目:高中化学 来源: 题型:填空题
 氮元素可形成卤化物、叠氮化物及配合物等
氮元素可形成卤化物、叠氮化物及配合物等查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 漂白粉溶液中通入适量的SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 用稀硝酸除去试管内壁银:3Ag+4H++NO3-=3Ag++NO↑+2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
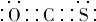 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | ②③⑤⑥ | C. | ①③④⑤⑥ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个-CH3,能生成4种一氯取代物 | B. | 3个-CH3,能生成3种一氯取代物 | ||
| C. | 3个-CH3,能生成4种一氯取代物 | D. | 2个-CH3,能生成4种一氯取代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com