
【题目】A、J是日常生活中常见的两种金属,J在化合物中存在两种正价;F是常温下的气体单质,各物质有以下的转化关系(部分产物及条件略去). 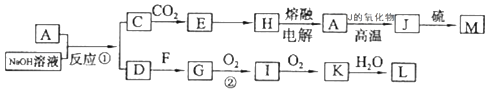
(1)A与NaOH溶液反应的离子方程式为;方程式中氧化剂为 .
(2)写出L的稀溶液与足量的J反应的化学方程式 .
(3)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色.X的水溶液与NaHCO3溶液混合,反应的离子方程式为 .
【答案】
(1)2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑;H2O
(2)3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
(3)Al3++3HCO3﹣=Al(OH)3+3CO2↑
【解析】解:(1)Al与氢氧化钠溶液反应离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,反应中水为氧化剂, 所以答案是:2Al+2H2O+2OH﹣=2AlO2﹣+3H2↑;H2O;(2)稀硝酸溶液与足量铁反应生成硝酸亚铁和NO,化学方程式为3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,
所以答案是:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O;(3)含Al元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色,说明含有钾元素,判断X为KAl(SO4)2 , X的水溶液与NaHCO3溶液混合,铝离子和碳酸氢根离子水溶液中双水解反应生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:Al3++3HCO3﹣=Al(OH)3↓+3CO2↑,
所以答案是:Al3++3HCO3﹣=Al(OH)3+3CO2↑.


科目:高中化学 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
(1)其中标示出使用温度的仪器是 .
(2)下列操作中,容量瓶所不具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数.其中为量筒的是 (填编号,),读数为mL.
(4)实验室用98%的浓硫酸配制 (浓硫酸的密度为1.84g/mL)450mL 0.1molL﹣1的硫酸.回答下列问题
①配制中应选用(写出规格)的容量瓶,应量取mL 98%的浓硫酸.
②量筒在使用前已洗干净但不干燥,对结果是否造成影响(填“是”或“否”),某同学认为将量筒内的浓硫酸倒出之后,应将量筒洗涤﹣下并将洗涤液并人烧杯中,最后转移到容量瓶中,你认为他的做法(填“对”或“错”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法中错误的是( )
A. 形成配位键的条件是一方有空轨道,一方有孤电子对
B. 配位键是一种特殊的共价键
C. 配位化合物中的配体可以是分子也可以是阴离子
D. 共价键的形成条件是成键原子必须有未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由甲酸甲酯、葡萄糖、乙醛、丙酸四种物质组成的混合物,已知其中氧元素的质量分数为37%,则氢元素的质量分数为( )
A.54%
B.63%
C.9%
D.12%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一.A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应.在浓硫酸存在下,A可发生如图所示的反应.试写出: 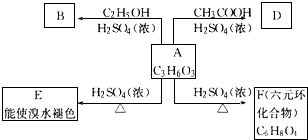
(1)化合物的结构简式:A; B; D
(2)化学方程式:A→E;A→F
反应类型:A→E;A→F .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合金A由两种常见金属组成.为测定其组成,某同学的实验流程如图所示: 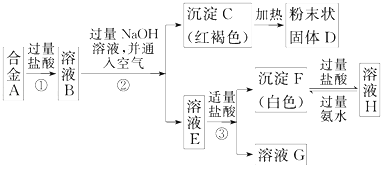
请回答:
(1)过程②中分离C和E的化学实验基本操作是;
(2)溶液H中所含的阳离子有(用离子符号表示);
(3)合金A与D在高温下反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com