
【题目】H2C2O4是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,下列溶液的离子浓度关系式正确的是( )
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2molL-1
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确且解释合理的是
说法 | 解释 | |
A | 一定温度压强下,2 g H2 和 4 g H2 完全燃烧,后者 燃烧热的数值大 | 4 g H2 放出热量多 |
B | 2SO2(g)+O2(g) 平衡后再加入 SO2,Q 增大 | 平衡右移,放出热量增多 |
C | 向等物质的量浓度的 NaI 和 KBr 混合液中滴加 AgNO3 溶液,先生成黄色 AgI 沉淀 | Ksp(AgI)<Ksp(AgBr) |
D | 等物质的量浓度 Na2CO3 的 pH 大于 CH3COONa | H2CO3 的酸性比 CH3COOH 强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应2SO2(g)+O2(g)![]() 2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
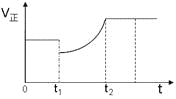
A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )

A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t ℃)时,水的Kw=1×10-12,则该温度____(填“>”“<”或“=”)25 ℃,其理由是_________________________________________________________。
(2)该温度下,c(H+)=1×10-7 mol/L的溶液呈_____(填“酸性、碱性或中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________ mol/L。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______(填“向左” “向右”或“不”,下同 )移动。在新制氯水中加入少量的NaCl固体,水的电离平衡________移动。
(4)25 ℃时,pH=4的盐酸中水的电离程度________(填“大于”“小于”或“等于”)pH=10的Ba(OH)2溶液中水的电离程度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com