

| NaCl浓度(g.L-1) 温度(℃) | 20 | 40 | 60 | 100 | 180 | 260 | 300 |
| 13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
| 50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
| 100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
分析 方铅矿(PbS)制备铅蓄电池电极材料(PbO2):盐酸调节pH,抑制Fe3+ 的水解,PbS溶解于FeCl3溶液,反应为:PbS+2FeCl3=PbCl2+2FeCl2+S,混合物A含有PbCl2、FeCl2、S、FeCl3、HCl,向其中加入饱和食盐水95℃溶解并趁热过滤,滤液B中有PbCl42-,蒸发浓缩后再用冰水浴得到PbCl2晶体,将晶体加入20%、密度为1.22g•cm-3的硫酸溶液,得到PbSO4,电解得到PbO2.
(5)①在电解池中,左极为阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,据此书写离子方程式;
②阴极的反应为8H++2NO2-+6e-=N2+H2O,据此分析.
解答 解:(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为:PbS+2FeCl3=PbCl2+2FeCl2+S;铁离子易水解诶,加入盐酸控制pH小于1.0可以抑制 Fe3+ 的水解;
故答案为:PbS+2FeCl3=PbCl2+2FeCl2+S;抑制 Fe3+ 的水解;
(2)根据PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0,含有PbCl2的混合物A浸泡溶解时采用95℃和饱和食盐水可以加快浸泡速率增大PbCl2在氯化钠溶液中的溶解度;
故答案为:加快浸泡速率;增大PbCl2在氯化钠溶液中的溶解度;
(3)根据题意:存在PbCl2(s)+2Cl-(aq)?PbCl42-(aq)△H>0,用冰水浴使反应PbCl2(s)+2Cl- (aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
故答案为:冰水浴使反应PbCl2(s)+2Cl- (aq)?PbCl42-(aq)平衡逆向移动,使PbCl42-不断转化为PbCl2晶体而析出;
(4)用溶质质量分数为98.3%、密度为1.84g•cm-3的浓硫酸配制溶质质量分数为20%、密度为1.22g•cm-3的硫酸溶液,需要的仪器有量筒、烧杯、玻璃棒;
故答案为:ABE;
(5)①在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②阴极的反应为8H++2NO2-+6e-=N2+H2O,当阴极区消耗2mol NO2-时,转移电子为6mol,减少8molH+,阳极Fe-2e-=Fe2+,得到3molFe2+,6mol正电荷,故有6mol右池减少的6molH+转移到右池,故右池减少的H+的物质的量为2mol;
故答案为:2.
点评 本题考查混合物的分离和提纯和原电池及电解池原理,为高考高频点,侧重考查学生分析、推断、知识运用能力,明确流程图中各个步骤发生的反应、操作方法、存在的物质等知识点即可解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
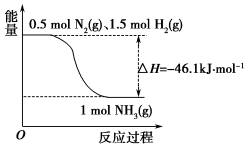 氨在工农业生产中应用广泛.
氨在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物的热稳定性:Y<W | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | Z和W的简单离子具有相同的电子层结构 | |
| D. | 化合物ZX2中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
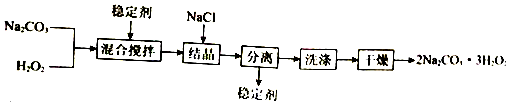
| A. | 可以用MnO2作稳定剂 | |
| B. | “结晶”时,加入NaCl的主要作用是增大产品的产率 | |
| C. | “分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒 | |
| D. | 2Na2CO3•3H2O2受热分解属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
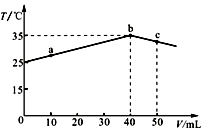
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )
如图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)?2Q(g)△H<0的影响.下列有关说法正确的是(反应容器的体积不变)( )| A. | x可能表示该反应的平衡常数 | |
| B. | x可能表示平衡混合物的密度 | |
| C. | 当x表示Q的体积分数时,T2<T1 | |
| D. | 当x表示平衡混合物的物质的量时,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
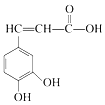
| A. | 与咖啡酸的物质类别完全相同(含咖啡酸),且苯环上只有3个取代基的同分异构体(包括顺反异构)有18种 | |
| B. | 1mol咖啡酸最多可与3molBr2反应 | |
| C. | 咖啡酸与 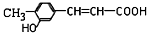 互为同系物 互为同系物 | |
| D. | 1mol咖啡酸与足量NaHCO3溶液反应产生3mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com