
(10分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
A |
| C |
| B |
|
(1)A、B、C三种元素的名称分别为 、 、 。
(2)B位于元素周期表中第 周期、第 族。
(3)C的原子结构示意图为 ,C的单质与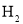 反应的化学方
反应的化学方
程式为 。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。
(1)氮、硫、氟 (2)三 ⅥA
(3)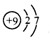 ;F2+H2=2HF
;F2+H2=2HF
(4)2NH3+H2SO4═(NH4)2SO4
【解析】
试题分析:(1)依题意,A、B、C为短周期元素,从A、B、C的相对位置看,A、C只能处在第二周期,而B处在第三周期.设A的原子序数为x-1,则C为x+1,B为x+8,则有:(x-1)+x+1=x+8 x=8.所以A、B、C的原子序数分别为7、16、9,对应的元素分别为N、S、F,故答案为:氮 硫 氟。
(2)S位于第三周期ⅥA主族。
(3)F原子核外有2个电子层,最外层7个电子,原子结构示意图为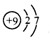 ;F2与H2反应生成氟化氢,化学方程式为:F2+H2=2HF
;F2与H2反应生成氟化氢,化学方程式为:F2+H2=2HF
(4)A的气态氢化物NH3与B的最高价氧化物对应水化物H2SO4反应生成(NH4)2SO4,化学方程式为:2NH3+H2SO4═(NH4)2SO4
考点:本题考查元素的推断、原子结构、元素周期表、结构示意图和方程式的书写。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
某铁合金与铁的物理性质的比较如下表所示:
| 熔点(℃) | 密度 (g /cm3) | 硬度(金刚石为10) | 导电性 (银为100) |
某铁合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该铁合金耐腐蚀,强度大。从以上性能看,该铁合金不适合用作( )
A.导线 B.门窗框 C.炉具 D.飞机外壳
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),

已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对
分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
A. g· cm-3 B.
g· cm-3 B. g· cm-3
g· cm-3
C. g· cm-3 D.
g· cm-3 D. g· cm-3
g· cm-3
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为:
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质的分子中,既有σ键又有π 键的是( )
A.C2H6 B.HClO C.CH4 D.CO2
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
下图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。下列关于此装置的叙述中,不正确的是( )

A.N上有气体放出
B.M为负极,N为正极
C.化学能转变为电能的装置
D.导线中有电流通过,电流方向由M到N
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:填空题
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的等电子体是 (写一种)。LiBH4中不存在的作用力有___(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_ _____。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF 。
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X—定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为 。

A.87.5% B.92.9% C.96.3% D.100%
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
下列实验操作使测定(或配制)结果偏高的是( )
A.配制一定物质的量浓度的溶液,定容时俯视刻度线
B.测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡
C.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
D.在敞口容器中测量氢氧化钠和稀盐酸反应的中和热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com