
����Ŀ��ijЩ�л����ʵķ���ʽ��ȡ�ʵ����λ���㣮���м����д�����ǣ� ��
A. �������ļ��顢��ϩ����Ȳ���ȼ�գ����ĵ����������ʵ�����������
B. Wg�����dz��ȼ�պ�ȼ�ղ��ᆳ��������Na2O2��ַ�Ӧ��������������Wg
C. �����������״��ϩ���������������������Ϊa����̼������������6/7(1-a)
D. �����ʵ������Ҵ����ϩ��![]() ���ȼ�գ����ĵ����������ʵ�����ͬ
���ȼ�գ����ĵ����������ʵ�����ͬ
���𰸡�A
��������
A.C��O2��4H��O2��
12 32 4 32
1g ![]() g 1g 8g��
g 1g 8g��
�������Ϲ�ϵ��֪����Ԫ�ص���������Խ�ߣ�������ʱ���ĵ����������ʵ���Խ��������������Ԫ������������С��ϵΪ�����飾��ϩ����Ȳ����������ļ��顢��ϩ����Ȳ���ȼ�գ����ĵ����������ʵ������μ�С����A����
B.����������������ȫȼ�գ�����CO2��H2O�����ɵ�CO2��H2O����Na2O2��Ӧ��Na2O2��CO2��Ӧ��2CO2+2Na2O2=2Na2CO3+O2������������m=2Na2CO3-2Na2O2=2CO����֪��Ӧ���������������ΪCO��������Na2O2��H2O��Ӧ��H2O+2Na2O2=4NaOH+O2������������m=2H2O-O2=4H����֪��Ӧ��������ӵ�����Ϊ��Ԫ�ص������������ǿ��Ա�ʾΪ����CO��6H12���������Ϸ�����֪��������ȼ�ղ�������������Ʒ�Ӧ��ʵ�������ӵ�����ǡ�õ��������ǵ���������ΪWg����B��ȷ��
C.����ķ���ʽΪC2H4O2����ϩ����ͨʽΪCnH2n���������̼��Ԫ��������Ϊ��12��2=6��1�����ڻ������OԪ����������Ϊa����C��HԪ�ص���������֮��Ϊ1-a�����Ի������̼Ԫ�ص���������Ϊ����1-a����![]() =
=![]() ����C��ȷ��
����C��ȷ��
D.�Ҵ�ȼ�չ�ϵʽΪ��C2H6O��3O2����ϩ�ᣨCH2=CH-COOH����������Ӧ��ϵʽΪ��C3H4O2��3O2�������ʵ������Ҵ����ϩ�����ĵ����������ʵ���һ����ͬ����D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�ԭ�ӵ������������Ǵ�����a����a>1�������ԭ�Ӻ����������ǣ� ��
A. 2a B. a+2 C. 2a+10 D. 2a+2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.2molij��A����������ȫȼ�պ�����CO2��H2O��Ϊ0.4mol����Aͨ��������Ȼ�̼��Һ�У���Һ��ɫ(��Ӧԭ����ͨ����ˮһ��)���Իش�
(1)��A�ĽṹʽΪ_________________________________��
(2)��Aͨ��������Ȼ�̼��Һ�У��йط�Ӧ�ķ���ʽΪ_______________________��
(3)�л���B��A�ڷ�������϶�һ��CH2ԭ���ţ��ṹ��A���ơ�д��B��һ�����������ɸ߷��ӻ�����Ļ�ѧ����ʽ________________________________________________��
(4)д������Һ�巴Ӧ�Ļ�ѧ����ʽ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ�������ڱ��е�λ����ͼ��������˵���������(����)
![]()
A. ��Y������⻯��ķе��M�ĵͣ���X���ʿ���ǿ����Һ��Ӧ
B. �������Ӱ뾶��M��Z��Y
C. ����������Ӧˮ��������ԣ�Z��M
D. ��Y���⻯���ˮ��Һ�ʼ��ԣ���X�������ﲻ���κ��ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.�����ǡ����Ǻ����Ƕ��ܷ���ˮ�ⷴӦ
B.���ࡢ��֬�������ʶ�����C��H��O����Ԫ����ɵ�
C.���ࡢ��֬�������ʶ��Ǹ߷��ӻ�����
D.��֬��ʳ������е���Ҫ���֣�Ҳ�Dz���������ߵ�Ӫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ƽ��״̬�ķ�Ӧ��X(s)��3Y(g)![]() 2Z (g)����H��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ���������
2Z (g)����H��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ���������
������ ������ ����ѹ ����ѹ ���Ӵ��� �������Z
A. �٢ۢ� B. �ڢۢ� C. �ڢۢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)������������ȷ����
4NO(g)+6H2O(g)������������ȷ����
A. �ﵽ��ѧƽ��ǰ����ѧ��Ӧ���ʣ�2v (NH3)=3v (H2O)
B. ����λʱ��������x mol NO��ͬʱ����x mol NH3����Ӧ�ﵽ��ѧƽ��״̬
C. �ﵽ��ѧƽ��״̬ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D. �ﵽ��ѧƽ��״̬ʱ��4v��(O2)=5v��(NO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2017������)��ѹ���ʻ�������������ԭ��Ϊ��Ni(s)+4CO(g)![]() Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
��һ�Σ���������CO��Ӧת������̬Ni(CO)4��
�ڶ��Σ�����һ�η�Ӧ���������������������230���Ƶøߴ�����
�����ж���ȷ����
A. ����c(CO)��ƽ���������ƶ�����Ӧ��ƽ�ⳣ������
B. �ڶ��Σ�Ni(CO)4�ֽ��ʽϵ�
C. ��һ�Σ���30����50������֮��ѡ��Ӧ�¶ȣ�ѡ50��
D. �÷�Ӧ�ﵽƽ��ʱ��v����[Ni(CO)4]=4v����(CO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѵĻ�������TiO2��Ti��NO3��4��TiCl4��Ti��BH4��2�Ⱦ����Ź㷺��;��
��1��д��Ti�Ļ�̬ԭ�ӵ���Χ�����Ų�ʽ_____��
��2��TiCl4�۵��ǩ�25�����е�136.4���������ڱ���CCl4���þ�������_____���壻BH4����Bԭ�ӵ��ӻ�����Ϊ_____��
��3���� TiO2�������£��ɽ�CN��������CNO���������õ�N2����CNO����Ϊ�ȵ�����ķ��ӻ�ѧʽΪ��ֻдһ�֣�________��
��4��Ti3+�����γ����ֲ�ͬ������[Ti��H2O��6]Cl3����ɫ����[TiCl��H2O��5]Cl2H2O����ɫ������ɫ������������_______��
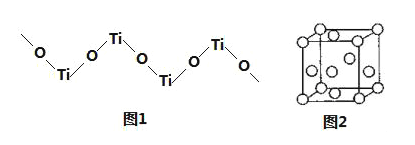
��5��TiO2������ˮ��ϡ�ᣬ��������Ũ���ᣬ���������������ӵľ��壬�������ӳ���Ϊ��״�ۺ���ʽ�������ӣ���ṹ��ʽ��ͼ1����ѧʽΪ______��
��6���������ڲ�ԭ�ӵĶѻ���ʽ�����������ѻ���ʽ����ͼ2�����þ������ܶ�Ϊ��gcm��3�������ӵ�����ΪNA����þ����ı߳�Ϊ___cm��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com