
【题目】已知草酸镍晶体(NiC2O42H2O)难溶于水,工业上从废镍催化剂(主要成分是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀.
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:______________________________________。
(2)试剂a是一种绿色氧化剂,写出氧化时反应的离子方程式:__________________________________。
(3)调节pH的范围为________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成:_____________。
(4)写出沉镍时反应的离子方程式:________________________________________________。证明Ni2+已经沉淀完全的实验步骤及现象是_____________________________________。当Ca2+沉淀完全时,溶液中c(F-)>________mol·L-1。
(5)操作a的内容是_____________________________________________________________。
【答案】 把废镍催化剂粉碎(或适当加热,适当增大酸的浓度或提高搅拌速率) 2Fe2++H2O2+2H+=2Fe3++2H2O 5.0≤pH<6.8 加入Ni(OH)2消耗溶液中的H+,促使Fe3+、Al3+的水解平衡右移,使铁离子,铝离子转化为相应的沉淀 Ni2++C2O42-+2H2O=NiC2O4·2H2O↓ 取适量上层清液放入试管中,继续滴加(NH4)2C2O4溶液,无沉淀生成 ![]() 过滤、洗涤,干燥
过滤、洗涤,干燥
【解析】(1)提高酸浸的速率,其实就类似于如何加速溶解,所以方法为:粉碎、搅拌、加热等。
(2)绿色氧化剂是指H2O2,在酸性条件下将亚铁离子氧化为铁离子,方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)调节pH的目的是使铁离子和铝离子完全转化为对应的氢氧化物沉淀,再过滤除去杂质,同时要保证溶液中的镍离子不沉淀,所以应调节5.0≤pH<6.8。加入氢氧化镍会与溶液中的氢离子反应,使体系的pH升高,从而使铁离子和铝离子的水解平衡正向移动,将其转化为氢氧化物沉淀进行分离。
(4)加入草酸铵得到草酸镍晶体沉淀,所以方程式为:Ni2++C2O42-+2H2O=NiC2O4·2H2O↓。证明镍离子沉淀完全,就是证明在溶液中已经不存在镍离子,所以方法为:取适量上层清液于试管中,继续滴加(NH4)2C2O4溶液,无沉淀生成。当Ca2+沉淀完全时,其离子浓度小于1×10-5mol/L,根据KSP表达式进行计算,得到溶液中c(F-)>![]() mol·L-1。
mol·L-1。
(5)操作a是为了从草酸镍的悬浊液中得到草酸镍晶体,所以操作a为:过滤、洗涤,干燥。


科目:高中化学 来源: 题型:
【题目】已知反应: 2SO3(g) ![]() 2SO2(g)+O2(g) △H>0,某温度 下,将2molSO3置于10L密闭容器中,反应达平衡后,SO3的平衡转化率(a)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO2(g)+O2(g) △H>0,某温度 下,将2molSO3置于10L密闭容器中,反应达平衡后,SO3的平衡转化率(a)与体系总压强(p)的关系如图甲所示。则下列说法正确的是

①由图甲推断,B点SO2的平衡浓度为03mol/L
②由图甲推断,A点对应温度下的平衡常数为1.25×10-3
③达平衡后,压缩容器容积,则反应速率变化图像可以用图乙表示
④相同压强、不同温度下SO3的转化率与温度关系如丙图所示
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PASNa(二水合对氨基水杨酸钠)是抗结核药,其结构简式如图化合物1所示,下列说法正确的是( ) 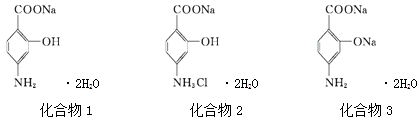
A.化合物1和化合物2均能使酸性KMnO4溶液褪色
B.化合物1的核磁共振氢谱测出5个谱峰
C.PASNa与足量盐酸反应生成如上图化合物2
D.通入足量CO2能将图化合物3转化为PASNa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。

请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________(写元素名称),它在周期表中的位置为_____________。
②写出B → C反应的离子方程式为___________________________________。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________、_________。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 ____________ g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A. b=a-n-mB. 离子半径Am+<Bn-
C. 原子半径A<BD. A的原子序数比B大(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A. 0.01 mol·L-1 B. 0.017 mol·L-1
C. 0.05 mol·L-1 D. 0.50 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com