

 4NH3+3O2,通入N2的一极是___ (填“阴极”或“阳极”),阳极的电极反应式是____。
4NH3+3O2,通入N2的一极是___ (填“阴极”或“阳极”),阳极的电极反应式是____。  挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:阅读理解

| 高温高压 |
| 催化剂 |
| ||
| 高温高压 |
| 催化剂 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市延庆县高三第一次模拟理综化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质
的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
。

③ 上图中的B点处,NH3的平衡转化率为_______。
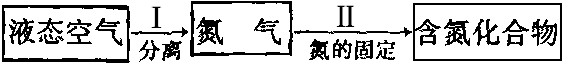
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:

①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH = ―1316 kJ/mol,则该燃料电池的负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4NH3+3O2
4NH3+3O2查看答案和解析>>
科目:高中化学 来源:2011年北京市朝阳区高考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com