
| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.15 mol•L-1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
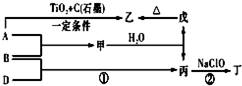 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).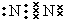 .写出丙的结构式
.写出丙的结构式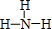 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | ①②③ | C. | ②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 只含有离子键的化合物才是离子化合物 | |
| C. | 并非只有非金属原子间才能形成共价键 | |
| D. | 由共价键形成的分子一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
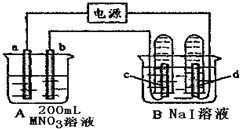
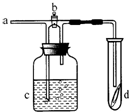 如图所示,从a处通入了氯气.若打开活塞b,d处的干燥有色布条不褪色,若关闭活塞b,d处的干燥有色布条褪色.下列判断正确的是( )
如图所示,从a处通入了氯气.若打开活塞b,d处的干燥有色布条不褪色,若关闭活塞b,d处的干燥有色布条褪色.下列判断正确的是( )| A. | c中盛放的不可能是NaCl溶液 | B. | c中盛放的可能是浓硫酸 | ||
| C. | c中盛放的可能是足量NaOH溶液 | D. | a处通入的是干燥的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═H2O | B. | NH3+HCl═NH4Cl | ||
| C. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com