
【题目】在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为
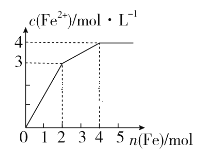
A.3∶1B.1∶2C.2∶1D.1∶1
【答案】D
【解析】
氧化性Fe3+> Cu2+,Fe先与氧化性强的物质反应,即先发生Fe+2Fe3+=3Fe2+,然后是Fe+Cu2+= Fe2++Cu,由图象可知,加入2mol Fe时,Fe与溶液中Fe3+恰好完全反应,从2mol-4mol消耗2molFe,溶液中Fe2+的浓度增加了1mol/L,因此消耗的Cu2+的物质的量为1mol,以此计算。
氧化性Fe3+> Cu2+,加入Fe后会依次发生①Fe+2Fe3+=3Fe2+,②Fe+Cu2+= Fe2++Cu,由图象可知加入2mol Fe时,发生反应①时,生成Fe2+的物质的量为6mol,参与反应的Fe3+的物质的量为4mol,即Fe2(SO4)3的物质的量为2mol,在加入2mol Fe的基础上再加2mol Fe发生反应②,此时生成Fe2+的物质的量为2mol,原溶液中Cu2+的物质的量为2mol,即CuSO4的物质的量为2mol,因此该溶液中Fe2(SO4)3与CuSO4的物质的量浓度之比为2mol:2mol=1:1;
答案选D。


科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如下:
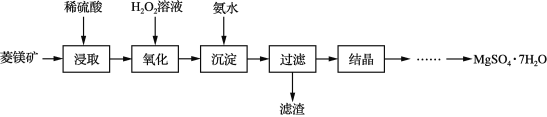
(1)“氧化”的过程目的是在酸性溶液中将Fe2+氧化为易被除去的离子,该过程发生反应的离子方程式是 _______________。
(2)“氧化”后的溶液与氨水反应生成的沉淀的化学式________,其颜色是_______。
(3)“过滤”所得滤液中含有的阳离子主要有______和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的能量变化示意图。
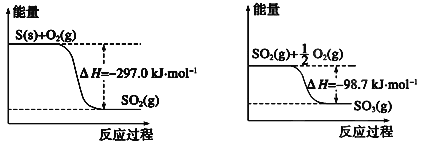
(1)1molS(g)与O2(g)完全反应生成SO2(g),反应的ΔH___-297.0kJ·mol-1(填“>”或“<”)
(2)写出S(s)与O2(g)反应生成SO3(g)的热化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于氯酸钠(NaClO3)具有吸湿性,不易保存,因此工业上常采用电渗析法将氯酸钠(NaClO3)转化成氯酸钾(KClO3),其工作原理如图所示(a、b两电极均为石墨电极,c、d、e依次为阳离子交换膜、阴离子交换膜、阳离子交换膜),下列法说不正确的是( )
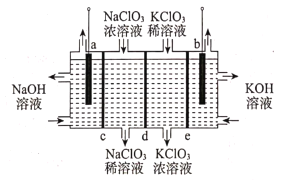
A.a电极连接电源负极
B.左池NaOH溶液出口浓度大于入口浓度
C.该电解池的工作原理实质是电解水
D.制备1molKClO3,a、b两极共产生16.8L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在农药、医药、工程塑料等方面都有广泛应用,光气常温下为无色气,有腐草味,低温时为黄绿色液体,化学性质不稳定,遇水迅速水解,生成氯化氢。某实验小组利用如下实验装置合成光气并利用光气与浓氨水反应制备尿素[CO(NH2)2]。主要实验装置(夹持装置略去)及操作步骤如下:
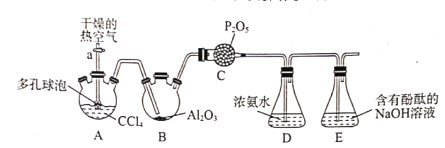
①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CC14+Al2O3=3COCl2+2AlC13
回答下列问题:
(1)检验整个装置的气密性的方法:___。
(2)步骤②中通入干燥的热空气的作用为___。
(3)装置C的作用___。
(4)装置D中反应除生成尿素[CO(NH2)2]外,还有NH4Cl生成,该反应的化学方程式为___。。
(5)分离装置D中混合液的操作名称为___。
(6)装置E中足量的NaOH溶液与少量的光气反应的离子方程式为:___。
(7)实验后,将D中溶液先蒸发结晶,再用重结晶的方法得到尿素晶体(含有少量的NH4Cl杂质),测定所得晶体中尿素的百分含量的方法:将7.07g晶体中所含氮完全转化为氨气所得氨气用100mL2.00molL-1的硫酸溶液完全吸收,取吸收液10mL用0.4000molL-1的氢氧化钠标准溶液滴定。
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为___(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数___(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.NaHS的水解:HS-+ H2O![]() S2-+ H3O+
S2-+ H3O+
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O = NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、W、M四种短周期主族元素,其原子序数依次增大,Y的原子半径是所有短周期主族元素中最大的,X的核外电子数与Y、M的最外层电子数之和相等,W的原子序数是M的最外层电子数的2倍,由X、Y、W三种元素形成的化合物G的结构如图所示。下列叙述不正确的是( )
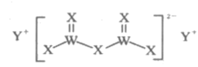
A.常见X的单质在常温下一定是气体
B.X、W的简单氢化物稳定性:X>W
C.单质Y与氧气反应的产物一定呈淡黄色
D.化合物G中X都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与0.2 L 1 mol/L FeCl3溶液中的氯离子的数目相同是( )
A.0.2 L 1 mol/L KCl溶液B.0.6 mol HCl气体
C.0.2 L 3 mol/L KClO3溶液D.0.6mol NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阳极 X 和阴极 Y 电解 Z 的水溶液,电解一段时间后,再加入 W,能使溶液恢复到电解前的 状态,则下列不符合题意的一组是
组号 | X | Y | Z | W |
A | C | Fe | NaCl | HCl 气体 |
B | Pt | Cu | CuSO4 | CuO |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com