

分析 氯酸钠(NaClO3)在酸性条件下与过氧化氢生二氧化氯,ClO2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)仪器A为安全瓶,冰水浴降低NaClO2的溶解度,降低温度,防止不稳定的物质分解;
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收;
(3)Clˉ存在时会催化ClO2的生成,反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气,则氯离子与氯酸根离子反应生成ClO2和氯气;
(4)过氧化氢受热易分解,故采用减压蒸馏的方式.
解答 解:(1)仪器A为安全瓶,防止倒吸;冰水浴冷却的目的是为降低NaClO2的溶解度;减少H2O2的分解;增加ClO2的溶解度;减少ClO2的分解用冰水浴冷却;
故答案为:防止倒吸;降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解;
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收,则空气流速过快或过慢,均降低NaClO2产率;
故答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解;空气流速过快时,ClO2不能被充分吸收;
(3)Clˉ存在时会催化ClO2的生成,反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气反应为,2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O,H2O2+Cl2═2Cl-+O2+2H+;
故答案为:2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O;
(4)过氧化氢受热易分解,故采用减压蒸馏的方式,则B处增加一个减压设备,馏出物为H2O,
故答案为:减压;H2O.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂和蛋白质都是高分子化合物,且它们都是混合物 | |
| B. | 淀粉、纤维素和葡萄糖都能发生水解反应 | |
| C. | 乙醛、乙酸和葡萄糖都能与新制的氢氧化铜悬浊液发生氧化反应 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
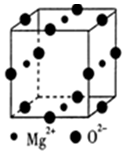 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.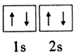 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).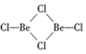 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.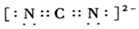 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com