
【题目】已知:25℃时,H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7 H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10-11 HClO Ka=3.0×10﹣8 饱和 NaClO 溶液的浓度约为 3mol/L.
(1)室温下,0.1mol/L NaClO 溶液的 pH _____0.1mol/L Na2SO3 溶液的 pH.(选填“大于”、小于”或“等于”)。浓度均为 0.1mol/L 的 Na2SO3 和 Na2CO3 的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为_______________。
(2)下列离子反应正确的有:__________。
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为 NaClO,还含有一定量的 NaOH 等,下列用来解释事实的方程式中不合理的是:__________。
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的 pH 约为12,主要是因为:ClO﹣+H2O![]() HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成 HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol 下列气体分别与 1L0.l mol·L﹣1 的 NaOH 溶液反应,形成的溶液的pH 由大到小的顺序为:_________(用 A、B、C 表示).
A.SO3 B.SO2 C.CO2
(5)下列说法不正确的是(_____)
A.一定温度下,pH相同的氨水和氢氧化钠等体积混合后溶液pH不变
B.含等物质的量的 NaClO、NaHCO3 混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH 溶液加水稀释后,溶液中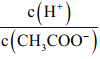 的值减小
的值减小
D.水中加入金属钠,虽反应生成了强碱氢氧化钠,但促进了水的电离
【答案】 大于 c(SO32﹣)>c(CO32﹣)>c(HCO3﹣)>c(HSO3﹣) B B C C>B>A C
【解析】(1)根据盐类水解中越弱越水解,同时电离平衡常数越大,越促进电离,因此NaClO的碱性强于Na2SO3,填“大于”,越弱越水解,电离平衡常数越小,说明电离能力越小,因此CO32-水解能力强于SO32-,且水解程度非常微弱,因此离子浓度大小c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);(2)利用电离程度强的制取电离程度弱的,A、H2SO3的第二步电离常数小于H2CO3的第一步,因此HCO3-+SO2=HSO3-+CO2↑,选项A错误;B、H2CO3的第二步电离常数小于HClO的,因此ClO-+CO2+H2O=HClO+HCO3-,选项B正确;C、因为次氯酸具有强氧化性,把+4S氧化成+6价,选项C错误;D、因为次氯酸具有强氧化性,把+4S氧化成+6价,选项D错误;答案选B;(3)A、氯气和氢氧化钠反应,生成NaCl、NaClO,故说法正确;B、消毒液pH=12,原因是含有一定量的NaOH,故说法错误;C、白醋是弱酸,不能拆写成离子,故说法错误;D、存在中间价态,因此有ClO-+Cl-+2H+=Cl2↑+H2O,故说法正确;答案选BC;(4)A、硫酸过量,浓度为0.05mol·L-1;B、生成NaHSO3;C生成NaHCO3;越弱越水解,水解程度:HCO3->HSO3-,因此碱性强弱:C>B>A;(5)A、两种碱的pH相同,等体积混合因此所得混合液的pH不变,选项A正确;B、根据物料守恒,c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3),选项B正确;C、加水稀释促进电离,H+和CH3COO-量相等,即比值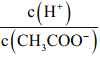 不变,选项C错误;D、向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,选项D错误;答案选C。
不变,选项C错误;D、向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,选项D错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是以有机物A合成聚酯类高分子化合物F的路线:

已知:
回答下列问题:
(1)A生成B的反应类型为_____,C中的官能团名称为________。
(2)D与NaOH水溶液反应的化学方程式为________。
(3)①E生成F的化学方程式为________。
②若F的平均相对分子质量为20000,则其平均聚合度为________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环状结构的G。G的结构简式为________。
(5)满足下列条件的C的同分异构体有_____种。(不考虑立体异构)
①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与斐林试剂反应产生2mol砖红色沉淀
(6)写出用![]() 为原料制各化合物
为原料制各化合物 的合成路线______。(其他试剂任选)
的合成路线______。(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业中铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
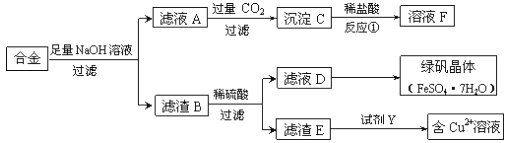
(1)操作①的名称是______________,滤渣B含有_______________(填化学式)。
(2)反应①的离子方程式是_________________________________。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作是______________、冷却结晶、过滤、自然干燥,这一系列操作中没有用到的仪器有________(填序号)。
A.漏斗 B.坩埚 C.烧杯 D.玻璃棒
(4)试剂Y应该是一种________(填“氧化剂”或“还原剂”),它不可能是____(填序号)。
A.过氧化氢 B.氢气 C.氧气 D.铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为7种短周期主族元素,其原子序数依次增大。A、C可形成A2C和A2C2两种化合物,B的最高正化合价与最低负化合价的绝对值之差为2,D和A同主族,E是地壳中含量最高的金属元素,F和C同主族且可形成FC2和FC3两种化合物。
(1)G的元素名称是__________,它在元素周期表中的位置是______________。
(2)F的质子数和中子数相等,F的原子组成符号为______,它的最高价为____价。
(3)C、D可形成一种淡黄色固体化合物,写出此化合物的电子式__________。
(4)由上述7种元素中的4种元素组成的化合物X,X既能与热的NaOH溶液反应,也能与稀盐酸反应,且均能生成无色气体,X的化学式是____________________。
(5)已知Se在第四周期,与S同主族,请任意写出一种含Se物质的化学式,预测其性质,并说明预测依据_______。
含Se物质化学式 | 性质 | 预测依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R 9种元素在周期表中的位置:(用元素符号回答)
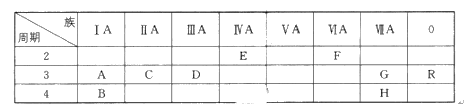
(1)这9种元素其中化学性质最不活泼的是________;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是_______________;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为________;
(4)F元素氢化物的化学式是________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜锌合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:

回答下列问题:
(1)H2O2的电子式为_________;“溶解”后铜元素的主要存在形式是______(填离子符号)。
(2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______________。
(3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应:
S2O32-+2H+=S↓+SO2↑+H2O
① 该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________。
[已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,则v(Na2S2O3)=_____mol/(L·s)(忽略溶液体积变化的影响)。
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_____________。
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN -):c(I-)≥_______________。
[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情况可能造成测得的铜含量偏高的是______(填标号)。
A. 铜锌合金中含少量铁
B. “沉淀”时,I2与I-结合生成I3- :I2+I-=I3-
C. “转化”后的溶液在空气中放置太久,没有及时滴定
D. “滴定”过程中,往锥形瓶内加入少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成金刚石的新方法化学原理为:①Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平);方法比人工首次制得金刚石的旧方法:②C(石墨)=C(金刚石)容易得多。以下表述中正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平);方法比人工首次制得金刚石的旧方法:②C(石墨)=C(金刚石)容易得多。以下表述中正确的是
A. 反应②中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是化学变化,旧方法利用的是物理变化
C. 在反应①中每生成12 g金刚石需要消耗46 g金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com