
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4LNO和22.4LO2混合后的分子总数为2NA
B.0.1molL-1的氨水中,溶液中各微粒的物质的量存在以下关系:n(![]() )+n(NH3)+n(NHH2O)=0.1mol
)+n(NH3)+n(NHH2O)=0.1mol
C.已知氢气的热值为143kJg-1,则氢气充分燃烧的热化学方程式可表示为:H2(g)+![]() O2(g)=H2O(l) ΔH=-286kJmol1
O2(g)=H2O(l) ΔH=-286kJmol1
D.用酸性高锰酸钾溶液检验火柴头燃烧产生的SO2气体,当10mL0.1molL-1的酸性高锰酸钾溶液刚好褪色时,转移的电子总数为0.0025NA
【答案】C
【解析】
A. 标准状况下,22.4L的气体为1mol,根据反应2NO+O2=2NO2,则NO完全反应,O2余下0.5mol,生成NO21mol,生成的NO2存在2NO2![]() N2O4平衡,所以混合后分子总数小于1.5NA,A错误;
N2O4平衡,所以混合后分子总数小于1.5NA,A错误;
B. 0.1molL-1的氨水中,没有氨水的体积,无法计算氮元素的物质的量,B错误;
C. 已知氢气的热值为143kJg-1,1mol氢气为2g,则1mol氢气放热2×143kJ=286kJ,所以热化学方程式可表示为:H2(g)+![]() O2(g)=H2O(l) ΔH=-286kJ mol1,C正确;
O2(g)=H2O(l) ΔH=-286kJ mol1,C正确;
D. 10mL0.1molL-1的酸性高锰酸钾物质的量为0.1molL-1×0.01L=0.001 mol,高锰酸钾被还原成Mn2+,每个Mn得到5个电子,则电子数为0.005 mol,所以转移的电子总数为0.005NA,D错误。
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2,经氧化、水解、聚合等步骤,可制备PFC。
(1)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为______; Fe2+在酸性条件下被O2氧化的离子方程式为_______。

(2)盐基度[B=![]() × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
(3)PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL1,样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家新研制的一种酸性乙醇电池(用磺酸类质子作溶剂),比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=== 2CO2+3H2O,电池构造如下图所示:
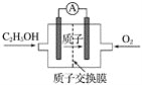
下列关于该电池的说法不正确的是( )
A. 通入乙醇的一极为负极
B. 正极反应式为4H++O2+4e-===2H2O
C. 负极反应式为C2H5OH-12e-+3H2O===2CO2+12H+
D. 随着反应的进行,溶液的酸性保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧物质X仅含三种元素,在198℃以下比较稳定,温度高时易分解.,某研究小组设计并完成如下实验:
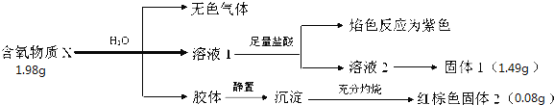
试回答如下问题:
(1)X的化学式为__________,写出X与H2O反应的离子方程式__________________
(2)工业上由红棕色固体2可以制备其单质,写出化学方程式____________________
(3)保存X时应注意_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)△H=-akJ/mol,已知: (a、b、c均大于零)
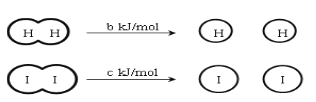
下列说法正确的是
A.碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞
B.断开2molHI分子中的化学键所需能量约为(c+b+a)kJ
C.相同条件下,1molH2(g)和1molI2(g)总能量小于2molHI(g)的总能量
D.向密闭容器中加入2molH2(g)和2molI2(g),充分反应后放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
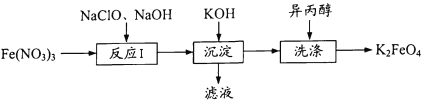
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
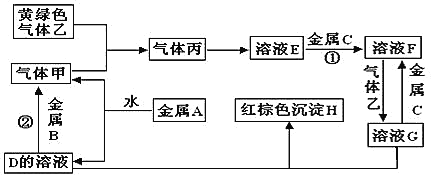
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A__________; G___________。
(2) 写出反应①的化学方程式:__________;写出反应②的离子方程式:_________。
(3)说出黄绿色气体乙的一种用途__________________。
(4)区别E、F两种溶液最简单的方法是______,实验室检验G中所含的金属离子时,常在G的溶液中加入_____溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com