
分析 ①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(g)═H2O(l)△H3
依据盖斯定律计算(①-②+4×③)×$\frac{1}{2}$得到热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$+2△H3,由此分析解答.
解答 解:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(g)═H2O(l)△H3
依据盖斯定律计算(①-②+4×③)×$\frac{1}{2}$得到热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$+2△H3=$\frac{-1275.6kJ/mol-(-566.0kJ/mol)}{2}+2×(-44.0kJ/mol)$=-442.8kJ∕mol,故答案为:-442.8kJ∕mol.
点评 本题主要考查了有关热化学方程式的计算,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
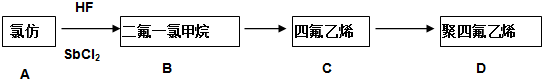
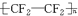 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
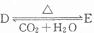 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可简写为
可简写为
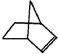
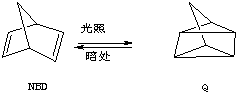
 ,系统命名为甲苯.
,系统命名为甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
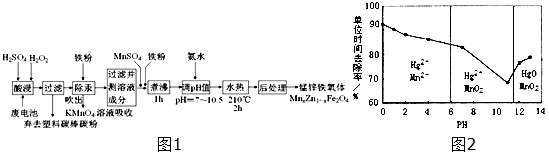
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
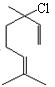 ;
;
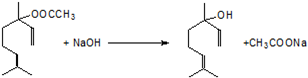 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、F-、Cl- | B. | K+、Cl-、CO32- | C. | HCO3-、Ba2+、I- | D. | Na+、NH4+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com