
下列离子组在指定溶液中能大量共存的是
A.中性溶液:Cu2+、Al3+、NO3-、SO42-
B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42-
D.常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
β—紫罗兰酮存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。
下列说法正确的是 ( )
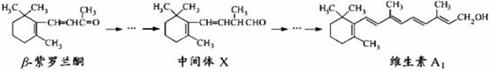
A.可用酸性KMnO4溶液鉴别中间体X中存在碳碳双键
B.β—紫罗兰酮与H2充分加成后中含3个手性碳
C.维生素A1易溶于水而较难溶于油脂
D.β—紫罗兰酮与中间体X互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不能按 (“→”表示一步完成)关系转化的是
(“→”表示一步完成)关系转化的是
| 选项 | A | B | C | D |
| a | NaOH | HNO3 | HCl | S |
| b | Na2CO3 | NO | Cl2 | SO3 |
| c | NaCl | NO2 | HClO | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系 (部分产物略去)。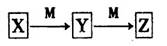
上述转化中X可能是下列物质中的
①S单质 ②AlCl3 ③NaOH ④NH3
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程如下图所示:

请回答下列问题:
(1)工艺流程中多次用到“过滤”操作,过滤操作中用到的玻璃仪器有 。
(2)实验过程中先“氨化”,后“碳酸化”,理由是 。
(3)工业纯碱含有少量碳酸氢钠,某兴趣小组为测定某工业纯碱中碳酸钠的质量分数,设计了下列实验方案:
方案一:分别称量干燥坩埚(m1g)和纯碱样品的质量(m2g),将纯碱样品放人坩埚中充分加热。将坩埚置于干燥器中冷却后称量,重复“加热、冷却、称量”操作多次后,最终称量坩埚和剩余样品的总质量为m3g,则样品中纯碱的质量分数为
 (用含m1、m2、m3的代数式表示)
(用含m1、m2、m3的代数式表示)
方案二:正确称取样品w g,用右图装置进行实验。
①装置C中试剂是 。
②E装置的作用是 ,若不连接E装置所测Na2CO3的质量分数 (填“偏大”、“偏小”或“无影响”)。
③反应前通入N2,反应后继续通人N2的目的是 。
(4)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知:酸性H2CO3>HClO>HCO3-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是
A.Na2CO3水解:CO32-+H2O=H2CO3+2OH-
B.AgCl溶于氨水:AgCl+2NH3·H2O=[Ag(NH3)2]++Clˉ+2H2O
C.向NaAlO2溶液中通入过量的CO2:2AlO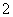 +CO2+3H2O=2Al(OH)3↓+CO32-
+CO2+3H2O=2Al(OH)3↓+CO32-
D.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
 | |||
 | |||
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.图8所知反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C.若在图7所示的平衡状态下,再向体系中充入He,此时v正>v逆
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
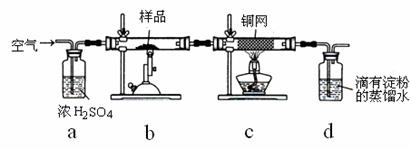
现用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol•L-1标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;
标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中。
到达滴定终点的现象
(2)装置a的作用是 。
A.除去空气中的二氧化碳 B.除去空气中的水蒸气
C.有利于气体混合 D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”) ,写出影响测定结果的化学方程式 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
(6)假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有
。
查看答案和解析>>
科目:高中化学 来源: 题型:
用学过的方程式解释下列问题。
(1)用离子方程式解释实验室盛装碱性溶液的试剂瓶用橡皮塞而不用玻璃塞的原因:
(2)用化学方程式解释漂白粉保存时应干燥的原因: 。
(3)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示SO2形成酸雨的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com