
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
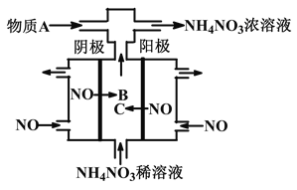
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
【答案】C
【解析】
A、阳极NO失电子发生氧化反应生成NO3-,电极反应式是:NO-3e-+2H2O=NO3-+4H+,故A错误;
B、阴极是NO得电子发生还原反应生成铵根离子,所以B是铵根离子,C是硝酸根离子,故B错误 ;
C、阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,因此若要使电解产物全部转化为NH4NO3,需补充NH3,故C正确;
D、电解过程中两个电极转移电离量一定相等,阴、阳两极转移的电子数之比为1∶1,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某厂利用一种天然产物进行发酵,发现发酵液中含有U、V、W、X等多种化合物。已知:①U和W均可与银氨溶液反应,析出金属银,而且U是一种单糖。②V是单官能团化合物,其碳原子数和X相同。V在浓硫酸作用下经加热得到Y,Y可以使溴水褪色。③V经缓和氧化可生成W。④V和X在少量浓硫酸作用下经加热可以得到Z。⑤X的组成为C 40%、H 6.7%、O 53.3%,X含有一个羧基,已知X的相对分子质量为90。X也可与乙酸起酯化反应。根据上述条件,回答下列问题:
(1)写出符合U的一种可能的单糖结构简式:___________。
(2)X的分子式是_____,其所有可能的结构简式是_________。
(3)V、W、Y、Z的可能的结构简式分别是:V_____,W_____,Y_______,Z______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
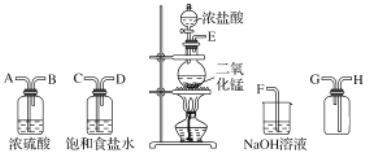
(1)连接上述仪器的正确顺序(填各接口处的字母):____ 接____;____接____;____接_____;____接____。
(2)装置中,饱和食盐水的作用是________;NaOH溶液的作用是_______。
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到_____,反应的化学方程式为________。
(4)写出下列反应的离子方程式:
①气体发生装置中进行的反应:____。
②NaOH溶液中发生的反应:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B. 苯甲酸的结构简式为![]()
C. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
D. C5H10的同分异构体中属于烯烃的有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
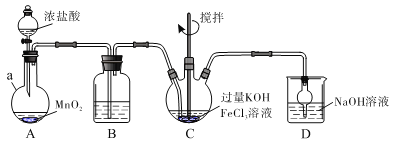
(1)仪器a的名称是____________,装置B中除杂质所用试剂是__________,装置D的作用是________________。
(2)A中发生反应的化学方程式为___________________________________。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为______,反应中KOH必须过量的原因是_____________________。
(4)写出C中总反应的离子方程式:__________________。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O![]() ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 (NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 (NH4)2Fe(SO4)2标准溶液28.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为__________。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_______(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
⑴过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
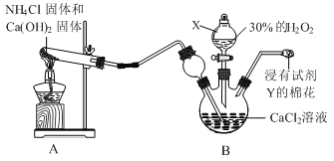
①装置A中发生反应的化学方程式为______。
②仪器X的名称为______;Y是______。
③为提高CaO2·8H2O产率,装置B的温度需控制在0℃,可采取的方法是______。
⑵测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.5000 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液体枳为20.00 mL。求产品中CaO2·8H2O的质量分数。(写出计算过程)_____________
已知:CaO2·8H2O+2KI+2H2SO4=CaSO4+2K2SO4+I2+10H2O
I2+2S2O32-=2I-+ S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性强于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是
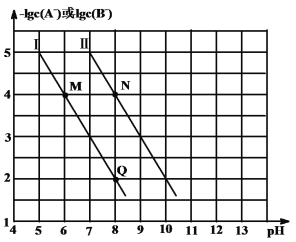
A.曲线Ⅰ表示溶液的pH与-lgc(B-)的变化关系
B.Ka(HA)∶Ka(HB)=1000∶1
C.溶液中水的电离程度:M<N
D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com