
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 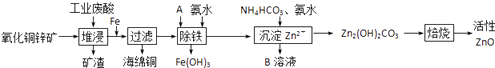
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .
【答案】
(1)<
(2)BC
(3)3.2~6.2
(4)(NH4)2SO4
(5)Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O
【解析】解:(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS),所以答案是:<;(2)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC,所以答案是:BC;(3)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2.故除铁PH范围为:3.2~6.2;(4)因所用废酸为硫酸,B又可作氮肥,所以B为NH4)2SO4 , 所以答案是:(NH4)2SO4;(5)由题给信息可知,反应物为2Fe(OH)3、ClO﹣、OH﹣ , 生成物之一为FeO42﹣ , 因铁在反应中化合价升高,故氯的化合价降低,故另一产物为Cl﹣ , 根据元素守恒,还有水是产物.根据化合价升降法配平此方程式为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此时该溶液中由水电离的c(OH-)=____________。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 环己烷与甲苯可用酸性KMnO4溶液鉴别
B. 淀粉和纤维素互为同分异构体
C. 植物油氢化过程中发生了氧化反应
D. 己烷有4种同分异构体,它们的熔点、沸点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中错误的是( )
A. Na2CO3=Na2++CO32- B. Na2SO4=2Na++SO42-
C. Ba(OH)2=Ba2++2OH- D. MgCl2=Mg2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 molL-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
Ⅰ催化还原法
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
则CH4将NO2还原为N2的热化学方程式为____________________________。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
2N2(g)+3H2O(g) ΔH < 0。为提高氮氧化物的转化率可采取的措施是_______________(写出1条即可)。
(3)在汽车排气管内安装的催化转化器,可使尾气中主要污染物转化为无毒物质。主要反应如下:2NO(g)+ 2CO(g)![]() N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
N2(g)+ 2CO2(g)。在一定温度下,向体积为1L的密闭容器中通入2molNO、1molCO,发生上述反应,10分钟时反应达到平衡状态,此时容器中CO变为0.6molL-1。
①前10分钟内用氮气表示的反应速率为___________,计算该温度下反应的平衡常数K为______Lmol-1。(只列算式,不要求计算结果)
②若保持温度不变,在15分钟时向容器内再次充入NO 1.6 mol、CO2 0.4 mol,则此时反应的ν正___ν逆(填“<”、“=”或“> ”)
II 氧化法。
(4)首先利用ClO2 氧化氮氧化物,再利用还原剂还原为无毒的氮气。其转化流程如下:
NO![]() NO2
NO2![]() N2。
N2。
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是_____________________________;若生成11.2 L N2(标准状况),则消耗ClO2____________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com