
【题目】现有下列几种有机物: A.CH4B.(CH3)2C=CH﹣CH3 C.C2H2
D.C6H14 E.CH2=CH﹣CH=CH2 F.环戊烷
(1)上述有机物中互为同系物的是 , 互为同分异构体的是 .
(2)用系统命名法对B进行命名 .
(3)A可与Cl2反应生成二氯甲烷,用﹣个化学方程式表示该反应 .
(4)B发生加聚反应的化学方程式为 .
(5)用个化学方程式表示C与足量溴水所反应的 .
(6)如图表示的是一种叫做双烯合成的有机反应,请写出 B 与 E发生双烯合成所得产物的结构简式 . ![]()
【答案】
(1)AD; BF
(2)2﹣甲基﹣2﹣丁烯
(3)CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
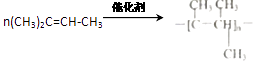
(4)
(5)CH≡CH+2Br2→CHBr2CHBr2
(6)
【解析】解:(1)同系物是结构相似,组成上相差CH2原子团的物质互称同系物,而AD的均为烷烃,故结构相似,在分子组成上相差5个CH2原子团,故互为同系物;分子式相同结构不同的有机物互为同分异构体,(CH3)2C=CH﹣CH3 的分子式为C5H10,环戊烷的分子式为C5H10,二者分子式相同,结构不同,互为同分异构体;
所以答案是:AD;BF; (2)(CH3)2C=CH﹣CH3 主链4个C,在2号和3号碳原子之间会形成一条碳碳双键,在2号碳原子上有一个甲基,所得产物的名称为:2﹣甲基﹣2﹣丁烯,
所以答案是:2﹣甲基﹣2﹣丁烯;(3)甲烷与氯气发生取代反应生成二氯甲烷,反应的方程式为:CH4+2Cl2 ![]() CH2Cl2+2HCl,
CH2Cl2+2HCl,
所以答案是:CH4+2Cl2 ![]() CH2Cl2+2HCl;(4)(CH3)2C=CH﹣CH3 发生加聚反应生成聚合物,反应的方程式为:
CH2Cl2+2HCl;(4)(CH3)2C=CH﹣CH3 发生加聚反应生成聚合物,反应的方程式为:  ,
,
所以答案是:  ;(5)乙炔能够和溴水发生加成反应,按1:2加成,生成1,1,2,2﹣四溴乙烷,反应的化学方程式为CH≡CH+2Br2→CHBr2CHBr2,
;(5)乙炔能够和溴水发生加成反应,按1:2加成,生成1,1,2,2﹣四溴乙烷,反应的化学方程式为CH≡CH+2Br2→CHBr2CHBr2,
所以答案是:CH≡CH+2Br2→CHBr2CHBr2;(6)(CH3)2C=CH﹣CH3 与CH2=CH﹣CH=CH2 发生双烯合成反应,二烯烃中的两个双键断裂,形成一个新的双键,所得产物的结构简式为 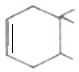 ,
,
所以答案是:  .
.
【考点精析】通过灵活运用芳香烃、烃基和同系物,掌握分子里含有一个或多个苯环的碳氢化合物,称为芳香烃,其中由一个苯环和饱和烃基组成的芳香烃叫苯的同系物,其通式为CnH2n–6(n≥6)即可以解答此题.


科目:高中化学 来源: 题型:
【题目】一氯化碘(沸点97.4℃),是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题:
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)

①各装置连接顺序为A→___________;A装置中发生反应的离子方程式为___________。
②B装置烧瓶需放在冷水中,其目的是:___________,D装置的作用是____________。
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为___________________。
(3)设计简单实验证明:
①ICl的氧化性比I2强:________________________________________________。
②ICl与乙烯能发生反应:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为__________,钒有+2、+3、+4、+5 等多种化合价,其中最稳定的化合价是______________,VO43-的几何构型为___________。
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
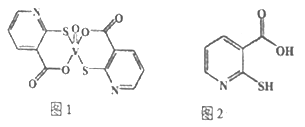
①该药物中S 原子的杂化方式是____________,所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是___________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域П键”,下列物质中存在“离域П键”的是___________。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为_____________。图4为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对铁生锈过行研究。
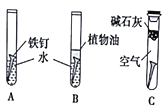
(1)甲同学设计了A、B、C组实验(如上图),探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁打不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是____________;
②铁钉发生电化学腐蚀的正极电极反应式为_____________;
③实验B所用的水要经过____处理;植物油的作用是____________;
④实验C中碱石灰的作用是___________。
(2)乙同学为了达到同样目的,设计了实验D(如图),发现一段时间后,试管中的表面升高,其原因是_________________。
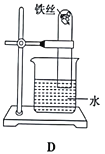
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )。
A.Fe3+、K+、Cl-、NO3-B.Ag+、Na+、NO3-、Cl-
C.Zn2+、Al3+、SO42-、Cl-D.Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.100molL﹣1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步: A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) .
(2)上述B步骤操作的目的是 .
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果(填“偏高“、“偏低”或“不变”).
(4)判断到达滴定终点的实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
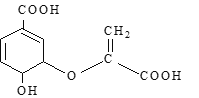
A. 分子中存在两种含氧官能团
B. 1mol该有机物可以分别与3molBr2和5molH2发生加成反应
C. 该有机物可以使溴水和酸性高锰酸钾溶液均褪色
D. 该有机物可以发生氧化反应、加成反应、取代反应和水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com