
| ����1����2mL 0.005mol•L-1 AgNO3��Һ�м���2mL 0.005mol•L-1KSCN��Һ�����ã� | ���ְ�ɫ������ |
| ����2��ȡ1mL�ϲ���Һ���Թ��У��μ�1��2mol•L-1Fe��NO3��3��Һ�� | ��Һ��Ϊ��ɫ�� |
| ����3������2����Һ�У���������5�� 3mol•L-1AgNO3��Һ�� | ����a���ְ�ɫ��������Һ��ɫ��dz�� |
| ����4������1���µ���Һ�м���5�� 3mol•L-1KI��Һ�� | ���ֻ�ɫ������ |
���� ��1����ֻҪ˵��һˮ�ϰ���ˮ��Һ�в��ֵ������֤��һˮ�ϰ���������Ը���һ��Ũ����Һ��pH��ǿ����ε�����Եȷ����жϣ�
��ʹ��ˮ����̶�����ˮ������笠����ӻ����������ӷ�Ӧ�����ʡ��������¶ȣ�
��2���ٴ���Ϊ���ᣬ����Ϊǿ�ᣬ��Ũ��ʱ�����pH��
����ͼ��ˮ�ĵ������������ã��ᡢ����Խǿ��ˮ�ĵ���̶�ԽС��
�۴�������ʾ���ԣ��Ȼ�����ʾ���ԣ�
��0.1mol•L-1 NaOH��Һ10mL����Һ���Ϊ20.00mL0.1mol•L-1�Ĵ��ᷴӦ���õ����Ǵ���ʹ����ƵĻ����ݴ�ȷ������Ũ�ȴ�С��
��3���������ӻ�������������֮�䷴Ӧ�õ�AgSCN��ɫ������
�ڳ������Ÿ����ܵķ���ת����
����50mL 0.005mol•L?1��AgNO3��Һ�м���150mL0.005mol•L?1�� KSCN��Һ��KSCN������������Һ��ʣ���KSCN��Ũ�ȣ����Ksp ��AgSCN �����㣮
��� �⣺��1����A����ˮ���Ȼ�������Ӧ��������������������˵��һˮ�ϰ��Ǽ������ˮ��һˮ�ϰ����ֵ��룬���Բ���˵����������ʣ���A����
B�������£�0.1mol•L-1��ˮpHΪ11����Һ�����ԣ�˵��һˮ�ϰ����ֵ��룬��˵��һˮ�ϰ���������ʣ���B��ȷ��
C����������ֽ�˵����β��ȶ�������˵��һˮ�ϰ����ֵ��룬����˵��һˮ�ϰ���������ʣ���C����
D�������£�0.1mol/L���Ȼ����ҺpHԼΪ5����Һ�����ԣ�˵���Ȼ����ǿ�������Σ���˵��һˮ�ϰ���������ʣ���D��ȷ��
�ʴ�Ϊ��BD��
��A��ͨ�백������ˮ��Ũ��������̶ȼ�С����A����
B�����������Ȼ������壬���������������ӣ���ٽ�һˮ�ϰ��ĵ��룬����̶�����B��ȷ��
C����ˮϡ�ͣ��ٽ�һˮ�ϰ��ĵ��룬����̶�����C��ȷ��
D�����������Ȼ�粒��壬笠�����Ũ���������ư�ˮ�ĵ��룬����̶ȼ�С����D����
�ʴ�Ϊ��BC��
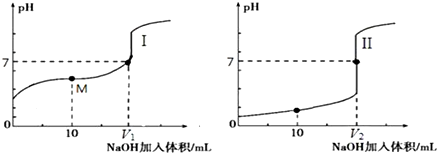
��2������ͼ��δ��NaOHʱ��pH��֪��ͼ�������pH����1��ͼ�������pH=1��˵����Ϊ0.1mol/L��������Һ��Ϊ������Һ�ζ����̣����Եζ������������I��
�ʴ�Ϊ��I��
��0.1mol•L-1 NaOH��Һ��0.1mol•L-1�������������Ӻ�������Ũ�ȶ���0.1mol/L����ˮ����������һ��������0.1mol/L������Һ��������Ũ��С��0.1mol/L�����Զ�ˮ�ĵ������ƽ�С����������Һ����ˮ�������c��H+��������0.1 mol•L-1������Һ���ʴ�Ϊ��0.1mol•L-1������Һ��
�۴������������֮��ķ�Ӧ����ǡ����ȫ��Ӧ�õ��Ĵ�������ʾ���ԣ�Ҫʹ����Һ��ʾ���ԣ�pH=7����Ҫ�����Թ����������������������ǡ����ȫ��Ӧ���õ����Ȼ�����ʾ���ԣ�����V1��V2���ʴ�Ϊ������
����0.1mol•L-1 NaOH��Һ10mL����Һ���Ϊ20.00mL0.1mol•L-1�Ĵ��ᷴӦ���õ����Ǵ���ʹ����ƵĻ�����ʾ���ԣ���ʱ����Ũ�ȴ�Сc��CH3COO-����c ��Na+����c ��H+����c ��OH-�����ʴ�Ϊ��c��CH3COO-����c ��Na+����c ��H+����c ��OH-����
��3���ټ����������������ӻ�������������֮�䷴Ӧ�õ�AgSCN��ɫ�������ʴ�Ϊ�����ְ�ɫ������
�ڣ�AgSCN��s��?Ag+��aq��+SCN-��aq��������KI����Ϊ�ܽ�ȣ�AgI��AgSCN�����������Ÿ����ܵķ���ת������Ag+��I-��Ӧ����AgI��ɫ������Ag++I-�TAgI����AgSCN���ܽ�ƽ�������ƶ���
�ʴ�Ϊ��AgSCN��s��?Ag+��aq��+SCN-��aq��������KI����Ϊ�ܽ�ȣ�AgI��AgSCN��Ag+��I-��Ӧ����AgI��ɫ������Ag++I-�TAgI����AgSCN���ܽ�ƽ�������ƶ���
����50mL 0.005mol•L?1��AgNO3��Һ�м���150mL0.005mol•L?1�� KSCN��Һ��KSCN��������Һ��ʣ���c��SCN-��=$\frac{0.005mol/L����0.15-0.05��L}{��0.15+0.05��L}$=0.0025mol/L��
��c��Ag+��=$\frac{Ksp��AgSCN��}{c��SC{N}^{-}��}$=$\frac{1{0}^{-12}}{0.0025}$=4��10?10mol•L?1��
�ʴ�Ϊ��4��10?10��
���� �����ۺϿ���ѧ�����ζ��Լ���Һ������Ũ�ȴ�С�Ƚϡ��ܶȻ��������йؼ���ȣ������ۺ�֪ʶ�Ŀ��飬ͼ������ж��ǽ���ؼ����Ѷ��еȣ������ڿ���ѧ���ķ��������ͶԻ���֪ʶ��Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2 | B�� | ��ˮ | C�� | NH3•H2O | D�� | Ba��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol•L-1 Na2CO3��Һ�У���CO${\;}_{3}^{2-}$��ĿС��NA | |
| B�� | 1mol FeCl3��ȫת��Ϊ����������������н���������ĿΪNA | |
| C�� | 25��ʱ��1L pH=12��Ba��OH��2��Һ�к��е�OH-��ĿΪ0.02NA | |
| D�� | 1mol���ͱ�����Ļ������ȫȼ��ʱ����O2�ķ�����Ϊ7.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ѡ�� | �������ʵ | ���� |
| A | ���ȵĴ�����Һϴȥ���� | Na2CO3��ֱ�������۷�Ӧ |
| B | �����£���������Ũ��ϡ�����зֱ������ͬ����Ƭ��Ũ��������Ƭ���ܽ��� | ��Ӧ��Ũ��Խ��Ӧ����Խ�� |
| C | ��pH�ơ��絼���ǣ�һ�ֲ�����Һ�������������������ɼ������������ˮ��̶� | ���������Ƿǵ���ʣ������ܵ��磬����ˮ����������ǵ���ʣ����ᣩ |
| D | FeCl3��Һ������ͭ��ӡˢ��·������ | FeCl3�ܴӺ�Cu2+����Һ���û���ͭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �к͵ζ�ʵ��ʱ���ô���Һ��ϴ��ƿ | |
| B�� | �ô���������ĥ��ƿʢ��NaOH��Һ | |
| C�� | �ñ���ȡ��ˮ�е���ʱ������ı���Һ�ӷ�Һ©���¿ڷų� | |
| D�� | NaCl��Һ�����ᾧʱ�����������о���������ʣ������Һ�弴ֹͣ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | 0.1032mol/LHCl��Һ���/mL | ����NaOH��Һ���/mL |
| 1 | 27.83 | 25.00 |
| 2 | 25.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| ��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| ��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
| Ksp | 1.8��10-10 | 5.0��10-13 | 8.3��10-17 | 2.0��10-48 | 1.8��10-10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
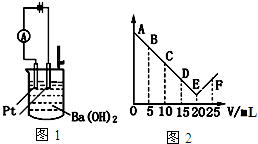
| A�� | ����Ļ�ѧʽΪHNO3 | |
| B�� | ����C��ʱ��Һ�е������������Ҫ��Ba2+��NH4+ | |
| C�� | �ձ��иռ�����ʱ���۲첻���а�ɫ�������� | |
| D�� | ��A��E����ǿ��I��С����Ҫԭ�����������ܵ��κ��ѵ����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư�ۼȿ���Ư������ֽ�ŵ�������ֿ�����Ӿ�ؼ������������� | |
| B�� | ���ʰ����̬���ʡ���̬���ʺ����� | |
| C�� | Ũ���ὦ��Ƥ����ʱ������ϡ����������Һ��ϴ | |
| D�� | �轺������ʳƷ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com