
海带中的碘元素是以I-的形式存在的,为将I-转化成I2并提取出来,设计操作步骤如下:①通入Cl2;②将海带烧成灰,向灰中加水,搅拌;③加CCl4振荡;④过滤;⑤用分液漏斗分液。合理的操作顺序为( )
A. ①③⑤②④ B.②①③④⑤ C.②④①③⑤ D.③①②⑤④
科目:高中化学 来源: 题型:
W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是( )
A、Na与水反应时增大水的用量 B、Fe与稀硫酸反应制取氢气时,改用浓硫酸
C、在H2SO4与Na2CO3两溶液反应时,增大压强 D、反应N2+3H2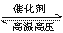 2NH3恒容增加氮气
2NH3恒容增加氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融) 2Na+Cl2↑ B.MgO+H2
2Na+Cl2↑ B.MgO+H2  Mg+H2O
Mg+H2O
C.Fe2O3+3CO  2Fe+3CO2 D.2HgO
2Fe+3CO2 D.2HgO  2Hg+O2↑
2Hg+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
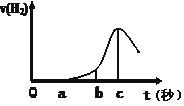 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是 (填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组材料中,能组成原电池的是
| A | B | C | D | |
| 两极材料 | 石墨、石墨 | Zn片、Cu片 | Zn片、Cu片 | 石墨、Cu片 |
| 插入溶液 | H2SO4溶液 | 乙醇溶液 | 稀盐酸 | H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种元素,期中A、B、C、D、E为短周期元素, 且原子序数依次增大。已知A和B具有相同的电子层数, 且A的L层电子数是K层电子数的两倍; C单质燃烧时呈现黄色火焰, C单质在高温下与B单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物; E元素的最低负价为负一价;F元素位于周期表中第四周期,它的氧化物中有一种常做涂料和红色油漆。试根据以上叙述回答:
(1)写出下列元素的名称: A ________, D ___________。
(2)写出B元素在周期表中的位置 。
(3)用电子式表示化合物 C2D 的形成过程 ___________________________。
(4)A与B形成的化合物均对环境能产生影响,请你写出一例 。
(5)写出B单质与C单质反应生成淡黄色化合物M的化学方程式 ;写出一例M的用途_______________。
(6)如何检验FE2溶液中的金属阳离子(答操作、现象及结论)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)所有金属纯度越大,越不易被腐蚀 ( )
(2)纯银器表面变黑和钢铁表面生锈腐蚀原理一样 ( )
(3)干燥环境下金属不被腐蚀 ( )
(4)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物 ( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+ ( )
(6)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(7)外加电流的阴极保护法,构成了电解池;牺牲阳极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀 ( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com