
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将1g碳酸钠固体和1g碳酸氢钠固体分别加入两支试管,加10mL水溶解后,滴加1~2滴酚酞溶液 | 碳酸钠溶液显红色,碳酸氢钠溶液显浅红色 | 碳酸钠溶液碱性比碳酸氢钠溶液碱性强 |
| B | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再加入CuSO4溶液中 | 无明显现象 | 铁不与CuSO4溶液反应 |
| C | 将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH | 前者的pH小于后者 | H2SO3酸性强于H2CO3 |
| D | 向2mL0.1mol/LNa2S溶液中滴入几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成,后又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
分析 A.相同浓度时,碳酸钠的水解程度大;
B.常温下Fe遇浓硝酸发生钝化;
C.饱和溶液的浓度不同,应测定等浓度溶液的pH比较酸性;
D.由操作和现象可知发生沉淀的生成.
解答 解:A.相同浓度时,碳酸钠的水解程度大,由现象可知碳酸钠溶液碱性比碳酸氢钠溶液碱性强,故A正确;
B.常温下Fe遇浓硝酸发生钝化,与硫酸铜溶液不反应液,但Fe可与硫酸铜反应,故B错误;
C.饱和溶液的浓度不同,应测定等浓度溶液的pH比较酸性,操作和现象不能说明结论,故C错误;
D.Na2S溶液过量,由操作和现象可知为沉淀的生成,则不能比较ZnS、CuS溶度积(Ksp),故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握溶解度与浓度的关系、物质的性质、沉淀转化为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 多糖和蛋白质都是高分子化合物 | |
| B. | 淀粉和纤维素分子式相同、结构不同,二者互为同分异构体 | |
| C. | 蛋白质和多糖在一定条件下都能发生水解反应 | |
| D. | 蛋白质具有酸碱两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有的共价键数为4 NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4 NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5 mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常
)可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常 简写为BnCl,
简写为BnCl, 简写为CbzCl ):
简写为CbzCl ):
 显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
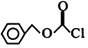 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为 (任写一种).
(任写一种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
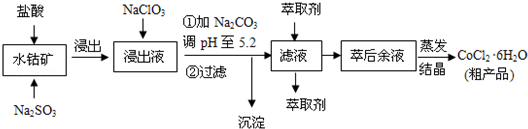
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.01mol•L-1•min-1 | B. | V(H2)=0.06mol•L-1•min-1 | ||
| C. | V(NH3)=0.02mol•L-1•min-1 | D. | V(H2)=0.002mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com